
(1)①25 ℃时,将20 mL 0.1 mol·L-1CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。

反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)。
A.c(CH3COO-) B.c(H+) C.KW D.醋酸电离平衡常数
E.
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+.Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。

(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ,c(H2C2O4) c(C2 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:2014高考名师推荐化学元素周期表及其应用(解析版) 题型:选择题
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是
A.W、M的某种单质可作为水处理中的消毒剂
B.电解YW2的熔融物可制得Y和W的单质
C.相同条件下,W的氢化物水溶液酸性比Z弱
D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Vm与它的推论应用(解析版) 题型:选择题
氢气的摩尔质量为M g·mol-1,密度是ρ g·L-1,阿伏加德罗常数为NA,则下列表述正确的是
A.单位体积中所含氢气分子数目NA/22.4
B.单位质量中所含氢气分子数目为ρ·NA
C.单个氢气分子的质量为M/NA g
D.单个氢气分子占有的体积为22.4/NA L
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:填空题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O △H2= -534.2kJ·mol-1
写出肼和N2H4反应的热化学方程式 ;
(3)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,4g CH4含nA个C—H共价键
B.1 mol Fe与足量稀HNO3反应,转移个2nA个电子
C.1L 0.1 mol/L NaHCO3溶液中含有0.1nA个HCO3-
D.常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
有关AgCl的沉淀溶解平衡的说法正确的是
A.AgCl沉淀生成和溶解同时在不断进行,且速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.用等体积的蒸馏水和0.01mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失小于用稀盐酸洗涤的损失量。
D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
已知25℃,Fe(OH)3(s) Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O
Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
A.Ksp·Kh=Kw3 B.Ksp·Kw=Kh
C.Kh/Kw=Ksp D.Kw/Kh=Ksp3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:简答题
【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为 ;
(2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 (只要求列算式,阿伏加德罗常数的值为NA)

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
【有机物化学基础】
以下是一种药物Ⅳ合成部分路线:

请回答下列问题:
(1)化合物Ⅰ的分子式为 ,它长期暴露在空气中会变质,其原因是 。
(2)化合物Ⅰ转化为Ⅱ的反应类型是 。
(3)化合物Ⅰ的同分异构体A含α-氨基苯乙酸,A的苯环对位含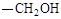 ,则A的结构简式是 ,A在催化剂的作用下通过肽键形成高聚物,试写出该反应的化学方程式 。
,则A的结构简式是 ,A在催化剂的作用下通过肽键形成高聚物,试写出该反应的化学方程式 。
(4)写出Ⅲ的结构简式 。
(5)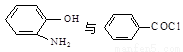 在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写出该反应的化学方程式 。
在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com