
| A. | 过量 Cl2:Fe2+、H+、Al3+、Cl-、SO42- | |
| B. | 过量SO2:Fe2+、H+、Al3+、SO42- | |
| C. | 过量氨水:NH4+、AlO2-、SO42-、OH- | |
| D. | 过量 Na2O2:Na+、Fe3+、SO42-、OH- |
分析 用过量硫酸浸取,SiO2不反应,滤液中含Fe2+、Fe3+、Al3+,
A.过量 Cl2与亚铁离子反应;
B.过量SO2与Fe3+反应;
C.过量氨水与Fe2+、Fe3+、Al3+均反应生成沉淀;
D.过量 Na2O2与Fe2+发生氧化还原反应后,与Fe3+反应生成沉淀,与Al3+反应生成偏铝酸钠.
解答 解:用过量硫酸浸取,SiO2不反应,滤液中含Fe2+、Fe3+、Al3+,
A.过量 Cl2与亚铁离子反应,则不能大量存在Fe2+,故A不选;
B.过量SO2与Fe3+反应,溶液中存在Fe2+、H+、Al3+、SO42-,故B选;
C.过量氨水与Fe2+、Fe3+、Al3+均反应生成沉淀,则不能大量存在AlO2-,故C不选;
D.过量 Na2O2与Fe2+发生氧化还原反应后,与Fe3+反应生成沉淀,与Al3+反应生成偏铝酸钠,则不能大量存在Fe3+,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 17 | C. | 20 | D. | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | b | |||||
| 3 | c | d | e | f |
| A. | 元素 a 是制备一种高效电池的重要材料 | |
| B. | 由于分子间氢键的作用,同族中由 b 元素形成的氢化物沸点是最高的 | |
| C. | c、d 两元素的单质构成原电池两电极时,d 可能为负极 | |
| D. | e、f 的含氧酸的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率 | |
| B. | 氢氧燃料电池正极消耗5.6 L气体时,电路中通过的电子数为6.02×1023个 | |
| C. | 若2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H<0 | |
| D. | 相同条件下,100 mL pH=3的HA溶液与HB溶液分别与足量的锌反应,HB放出氢气较多,说明HB酸性比HA的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
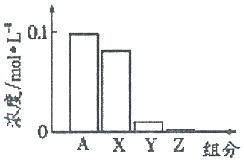 常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )
常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )| A. | A代表Na+浓度 | |
| B. | 该溶液中c(OH-)>c(Y) | |
| C. | 向该溶液中加水稀释,所有离子浓度均减小 | |
| D. | 该混合溶液中:c(X)+c(Y)+c(Z)═2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{②}^{NaOH,乙醇,△}$
$→_{②}^{NaOH,乙醇,△}$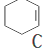 $→_{③}^{溴CCl_{4}溶液}$D$\stackrel{④}{→}$
$→_{③}^{溴CCl_{4}溶液}$D$\stackrel{④}{→}$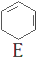
 ,名称是环己烷;
,名称是环己烷; ;B水解的化学方程式为
;B水解的化学方程式为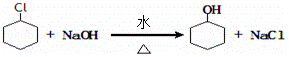 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 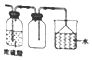 利用图收集干燥的氯化氢气体 | |
| B. | 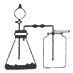 选择合适的试剂,利用图2可分别制取并收集少量CO2、NO和O2 | |
| C. |  利用图可验证铁发生吸氧腐蚀 | |
| D. |  利用图蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解精炼铜时,当电路中通过的电子数为2NA时,阳极质量减少64g | |
| B. | 标准状况下,22.4 LCO和C2H4混合气体的总分子数为NA,质量为28g | |
| C. | 常温常压下,1mol甲基(-CH3)所含电子数为10NA | |
| D. | 标准状况下,11.2L苯中含有C-H键的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com