
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
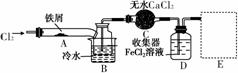
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为____________________________________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是____________________________________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为____________________________________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:____________________________________________________________。
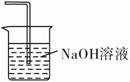
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为____________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②____________________________________________________________。
解析 (1)装置A中Fe在加热条件下与Cl2反应生成FeCl3:2Fe+3Cl2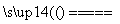 2FeCl3。
2FeCl3。
(2)根据题目信息可知,加热时FeCl3固体易升华,所以沉积在装置A右端的FeCl3经加热使其变为气体而进入收集器。
(3)要防止FeCl3潮解,则装置中不能存在水蒸气,从实验步骤表述中分析,②⑤都涉及“干燥”,其目的都是防止FeCl3潮解。
(4)进入收集器的FeCl3为气体,经装置B中的冷水冷却后而沉积下来,便于收集产品。Fe2+的检验可用K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]溶液反应生成蓝色沉淀。
(5)由于尾气中含有未反应的有毒气体氯气,可用盛有NaOH溶液的装置吸收,并将导管插入液面下。
(6)Fe3+具有氧化性,H2S具有还原性,二者发生氧化还原反应:2Fe3++H2S===2Fe2++S↓+2H+。
(7)FeCl3与H2S反应后的溶液中,主要存在Fe2+、H+和Cl-。电解时,H+在阴极得到电子生成H2,由于还原性Fe2+>Cl-,所以Fe2+在阳极失去电子生成Fe3+:Fe2+-e-===Fe3+。
(8)FeCl3与H2S反应后的溶液经电解后又生成FeCl3,FeCl3得到循环利用。
答案 (1)2Fe+3Cl2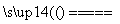 2FeCl3 (2)在沉积的FeCl3固体下方加热 (3)②⑤ (4)冷却,使FeCl3沉积,便于收集产品 干燥管 K3[Fe(CN)6]溶液
2FeCl3 (2)在沉积的FeCl3固体下方加热 (3)②⑤ (4)冷却,使FeCl3沉积,便于收集产品 干燥管 K3[Fe(CN)6]溶液
(5)
(6)2Fe3++H2S===2Fe2++S↓+2H+
(7)Fe2+-e-===Fe3+ (8)FeCl3得到循环利用


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
有关盐类水解的说法中不正确的是( )
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆反应
C.盐类的水解使盐溶液不一定呈中性
D.任何可溶性的盐均可发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硫及其化合物的说法中正确的是( )。
A.自然界中不存在游离态的硫
B.二氧化硫的排放会导致光化学烟雾的产生
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可用来干燥SO2、CO、Cl2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可制备出超高强度的高性能混凝土。下列关于二氧化硅的说法正确的是
( )。
A.二氧化硅溶于水生成硅酸,所以二氧化硅属于酸性氧化物
B.将二氧化碳通入硅酸钠溶液中可以得到硅酸
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.水晶是比较纯净的二氧化硅,沙子的主要成分是硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:
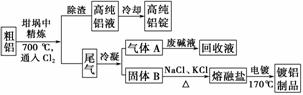
(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①____________________________________________________________和
②____________________________________________________________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为____________________________________________________________。
(4)镀铝电解池中,金属铝为________极,熔融盐电镀液中铝元素和氯元素主要以AlCl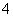 和Al2Cl
和Al2Cl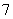 形式存在,铝电极的主要电极反应式为____________________________________________________________。
形式存在,铝电极的主要电极反应式为____________________________________________________________。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )
A.10℃ 20 mL 3 mol·L-1的X溶液
B.20℃ 30 mL 2 mol·L-1的X溶液
C.20℃ 10 mL 4 mol·L-1的X溶液
D.10℃ 10 mL 2 mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B(g)
 C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行的最快的是( )
C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行的最快的是( )
A.v(A)=0.15 mol·L-1·min-1 B.v(B)=0.6 mol·L-1·min-1
C.v(C)=0.4 mol·L-1·min-1 D.v(D)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K,沸点为588 K。工业上制备无水FeCl3的一种工艺流程如下:

(1)氯化铁能用作水处理剂的原因是__________________________________________________________
(用必要的文字和化学方程式说明)。
(2)吸收塔中吸收剂X是________________________,有关反应的离子方程式是________________________。
(3)温度超过673 K时,捕集器中捕集到的物质的相对分子质量为325,该物质的分子式为________________。
(4)从副产物FeCl3溶液中获得FeCl3·6H2O的方法是__________________________________________________________。
(5)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。用化学方法回收废液中铜的方法是__________________________(用反应式表示并简述操作要点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com