
| A. | 此合金的熔点比镁和铝的熔点都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 此合金的硬度比镁和铝的硬度都小 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
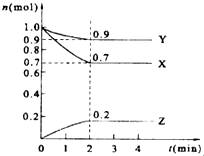 某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是非金属 | |
| B. | 它是非金属氧化物 | |
| C. | 二氧化硅能跟氢氧化钠反应生成盐和水 | |
| D. | 它的对应水化物是弱酸,能溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性 | |
| C. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 | |
| D. | Li、Na、K的原子半径和密度随原子序数的增加而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.1 mol•L-1 Na2SO4溶液中,粒子总数是0.03NA | |
| B. | 常温常压下,32 g O2-中所含电子的数目为17NA | |
| C. | 1 mol Al3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 $\stackrel{过氧化物}{→}$
$\stackrel{过氧化物}{→}$  (R,R′代表烃基)
(R,R′代表烃基) .
. .
. .
. .
. 或
或 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化镁与硫酸溶液反应:OH-+H+═H2O | |
| C. | 氢氧化钡溶液与稀硫酸的反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将金属Cu加入FeCl3溶液中:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com