
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a �ĺ����������������������ͬ��b�ļ۵��Ӳ��е�δ�ɶԵ�����3����c������������Ϊ���ڲ��������3����d��cͬ�壻e�������ֻ��1�����ӣ����������18�����ӡ��ش��������⣺
��1��b��c��d�е�һ������������ ����Ԫ�ط��ţ���e�ļ۲���ӹ��ʾ��ͼΪ ��
��2��a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ �������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ������� ���ѧʽ��д�����֣���
��3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������ ������������ṹ������ �����ѧʽ��
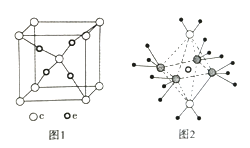
��4��e��c�γɵ�һ�����ӻ�����ľ���ṹ��ͼ1����e���ӵĵ��Ϊ ��
��5����5��Ԫ���γɵ�һ��1:1�����ӻ������У������ӳ�������ṹ�������ӳ����������İ�����ṹ����ͼ2��ʾ�����û������У�������Ϊ ���������д��ڵĻ�ѧ�������� ���û��������ʱ����ʧȥ������� ���ж������� ��
���𰸡���1��N ��![]()
��2��sp3��H2O2��N2H4
��3��HNO2��HNO3��H2SO3��4��+1
��5��SO42�����ۼ�����λ�� H2O H2O��Cu2������λ����NH3��Cu2������
�������������������������֪�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������Ӳ�����ͬ����aΪ��Ԫ�أ�b�ļ۵��Ӳ��е�δ�ɶԵ�����3������bΪ��Ԫ�أ�c������������Ϊ���ڲ��������3������cΪ��Ԫ�أ�d��cͬ���壬��dΪ��Ԫ�أ�e�������ֻ��1�����ӣ����������18�����ӣ���eΪͭԪ�ء�
��1����������������b��c��d�ֱ�ΪN��O��S��ͬ�����������ҵ�һ�����ܳʵ������ƣ�����Ԫ�ص�ԭ�ӹ����ȫ����ȫ�ա������״̬ʱ�����ȶ���ͬ�������ϵ��µ�һ��������С����ԭ��2p���Ϊ�����״̬�����ȶ�����N��O��S�е�һ������������N��eΪͭԪ�أ��۲���ӹ��ʾ��ͼΪ![]() ��
��
��2��aΪ��Ԫ�أ�������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷���Ϊ�����ӣ�����ԭ�ӵ��ӻ���ʽΪsp3�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ�������H2O2��N2H4��C2H6�ȡ�
��3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������HNO2��HNO3������������ṹ������H2SO3��
��4������O��Cu�γɵ����ӻ�����ľ����ṹ�жϣ��û�����Ļ�ѧʽΪCu2O��e���ӵĵ��Ϊ+1��
��5�����������Ϣ֪����5��Ԫ���γɵ�һ��1:1�����ӻ������У������ӳ�������ṹ��Ϊ��������ӣ������ӳ����������İ�����ṹ���ͼ2֪����û�����Ļ�ѧʽΪ[Cu(NH3)4(H2O)2]SO4���û�������������ΪSO42�����������д��ڵĻ�ѧ�������й��ۼ�����λ�����û��������ʱ����ʧȥ�������H2O���ж�������H2O��Cu2������λ����NH3��Cu2��������


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��úȼ���ŷŵ�����������Ҫ��SO2��CO2����SO2�γ����ꡢ��Ⱦ�������������������ش��������⣺
��1������Ca��ClO��2��������ɵõ��Ϻõ�Ч������֪���з�Ӧ��
��SO2��g��+2OH ��aq�� ��SO32 ��aq��+H2O��l�� ��H1
��ClO ��aq��+SO32 ��aq�� ��SO42 ��aq��+Cl ��aq�� ��H2
��CaSO4��s�� ��Ca2+��aq��+SO42��aq�� ��H3
��ӦSO2��g��+ Ca2+��aq��+ ClO ��aq�� +2OH ��aq�� �� CaSO4��s�� +H2O��l�� +Cl ��aq���Ħ�H=_ ��
��2��������ˮ�����������տɵõ����ʡ�����ͬ���ʵ�����SO2��NH3����ˮ������Һ��c��H+����c��OH-���� ������ĸ�������
A��c��SO32-����c��H2SO3��
B��c��SO32-��+c��NH3��H2O����c��H2SO3��
C��c��HSO3-��+c��SO32-����c��NH4+��
D��c��HSO3-��+2c��SO32-����c��NH4+��
��3�������ڽϸ��¶Ⱦ���ͼ�����ѳ�SO2�����Ƶ�H2SO4��
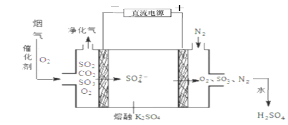
���������ŵ�������� ��
������������SO3�ĵ缫��Ӧʽ�� ��
����֪�����£�Ksp��BaSO4��=1��1��10��10�����ѳ�SO2���Ƶõ�H2SO4���pH��4 ��H2SO4��Һ����pH��9�� Ba��OH��2 ��Һ��ϣ������û����Һ�� pH��7���� Ba��OH��2 ��Һ�� H2SO4 ��Һ�������Ϊ ����ʹ��Һ��c��SO42���� ��2��0��10��4mol��L-1����Ӧ������Һ�� c��Ba2���� �� mol��L-1��
��4��һ������������Fe2O3��NiO��Cr2O3���������������·�Ӧ����ȼú�����е���ӦΪ��2CO��g����SO2��g��![]() 2CO2��g����S��l�� ��H= - 270KJ��mol-1����������ͬ��������ͬʱ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼ1�������������ļ۸����أ�ѡ��_ Ϊ�÷�Ӧ�Ĵ�����Ϊ������ѡ���������
2CO2��g����S��l�� ��H= - 270KJ��mol-1����������ͬ��������ͬʱ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼ1�������������ļ۸����أ�ѡ��_ Ϊ�÷�Ӧ�Ĵ�����Ϊ������ѡ���������

a�� Cr2O3 b�� NiO c�� Fe2O3
ѡ��ô����������ǣ�_ ��
ij����С����ѡ�����������380��ʱ���о���n��CO�� : n��SO2���ֱ�Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����淴ӦA(g) �� 3B(g)![]() 2C(g)�ﵽƽ��ı�־��
2C(g)�ﵽƽ��ı�־��
A�������ڵ�ѹǿ����ʱ��仯
B��A��B��C��Ũ�Ȳ��ٱ仯
C����λʱ��������n mol A��ͬʱ����2n mol C
D��A��B��C�ķ�����֮��Ϊ1�U3�U2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧѧϰ�˻�ѧ��Ӧ���ʺ����뵽����H2O2�Ʊ���������������������ʵ�鷽��������ʵ��̽����
ʵ���� | �� Ӧ �� | �� �� �� |
�� | �Թ��м���3 mL 2�� H2O2��Һ��3������ˮ | �� |
�� | �Թ��м���3 mL 5�� H2O2��Һ��3������ˮ | �� |
�� | �Թ��м���3 mL 5�� H2O2��Һ��3������ˮ | 1 mL 0.1 mol/L FeCl3��Һ |
�� | �Թ��м���3 mL 5�� H2O2��Һ��3��ϡ������Һ | 1 mL 0.1 mol/L FeCl3��Һ |
�� | �Թ��м���3 mL 5�� H2O2��Һ��3��NaOH��Һ | 1 mL 0.1 mol/L FeCl3��Һ |
���������ϡ���������(H2O2)����ˮ��Һ�׳�˫��ˮ����������һ����ɫҺ�壬���ʱȽ��ȶ����ڼ��ȵ������£����ֽܷ������������о������������Ƶ�5����H2O2��Һ���ȵ�65��ʱ���������ų������ȵ�80��ʱ���н϶�����������
��1������ʵ�鷢����Ӧ�Ļ�ѧ����ʽΪ ��
��2��ʵ���ʵ���ҵ�ʵ��Ŀ���� ��
ʵ�����ʵ�鶡��ʵ�����ʵ��Ŀ���� ��
��3������ݸ�ͬѧ���ĵ����Ϸ���H2O2�����ʣ�����ʵ���ʵ�����ܷ�ﵽʵ��Ŀ�ģ� ��
��4��ʵ������и�ͬѧ��ʵ������������в�������������ռ�������2������6��ʱ����ע������������ж�������¼�������±���
ʱ�䣯s | 20 | 40 | 60 | 80 | 100 | 120 | |
���������mL | ʵ��� | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
ʵ�鶡 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
ʵ���� | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
����ʵ���죬0��20 s�ķ�Ӧ����v1�� mL/s��100��120 s�ķ�Ӧ����v2�� mL/s��
������ʵ��������������ʴ��ڲ������Ҫԭ���� ��
������ͼ�Ǹ���ʵ���ռ���������������ʱ����ʱ����Ƶ�ͼ������c��ʾ����ʵ�� (������������������������)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͭ�Ƚ������仯�������ճ�������Ӧ�ù㷺�����������ʵ��ش����⡣
(1)�����к���һ����̼������X(Fe3C)��X�������Ŀ����и������գ������д��ԵĹ���Y����Y���ڹ����������Һ�д������ڵ���������_______________________��
Y�����Ũ���ᷴӦ����Һ�к��е��εĻ�ѧʽΪ__________��
(2)ij��Һ�к���Mg2����Fe2����Al3����Cu2�������ӣ������м��������NaOH��Һ���ˣ��������������ղ������պ�Ĺ���Ͷ�뵽������ϡ�����У�������Һ��ԭ��Һ��ȣ���Һ�д������ٵ���������________(����ĸ)��
A��Mg2�� B��Fe2�� C��Al3�� D��Cu2��
(3)����������Ҫ��ҵ���ϣ��÷���м�Ʊ������������£�

�ش��������⣺
�ٲ������������________���������������________________��
������ķ���Ϊ________________________________________________________��
��Na2CO3��Һ���Գ����ۣ�ԭ����(�����ӷ���ʽ��ʾ)_______________��
�����������FeCO3���������ӷ���ʽ��_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��л��������˵��������ǣ� ��
A��ú�ĸ���ʯ�͵ķ���ֱ��ǻ�ѧ�仯�������仯
B��������˿���ϳ���ά����Ҫ�ɷֶ�����ά��
C����֬�ɿ�����֬���ᣨ��Ӳ֬�ᡢ��֬��ȣ�����;�������Ӧ���ɵ���
D�����������Ƶ�������ͭ����Һ���黼����Һ�е�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ�뼼���ǸĽ������������.�ٽ���չ�Ĺؼ�������˵����ȷ���� �� ��
A����ͨ���������������ɡ�ˮ�����ﶼ�ǹ�������Ʒ
B�����Ҵ�����������Ҫ�ɷֶ��ǿ�������Դ
C����ʯ��������ͭ���轺��������ʳƷ�����
D������m��ϵ�зɴ�ʹ�õ�̼��ά���������ά�����������ǽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵľ���������ѧ��������ͬ����������Ҳ��ͬ���ǣ� ��
A��CO2��H2O B��CCl4��KCl C��NaCl��HCl D��SO2��SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ni-Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd + 2NiOOH + 2H2O![]() Cd��OH��2 + 2Ni��OH��2���йظõ�ص�˵����ȷ���ǣ�
Cd��OH��2 + 2Ni��OH��2���йظõ�ص�˵����ȷ���ǣ�
A�����ʱ������Ӧ��Ni��OH��2 �� e��+ OH��=NiOOH + H2O
B���������ǻ�ѧ��ת��Ϊ���ܵĹ���
C���ŵ�ʱ����������Һ�ļ��Բ���
D���ŵ�ʱ�������Һ�е�OH���������ƶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com