
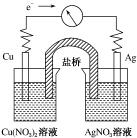
 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | Cu作负极,发生还原反应 | |
| C. | 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 | |
| D. | 工作一段时间后,AgNO3溶液中c(Ag+)减小 |
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:解答题
| 步骤I | 称取样品w g配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤II | 向锥形瓶中加入足量KI 晶体,充分搅拌,并加入少量指示剂 |
| 步骤III | 用c mol/L的Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | amol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.122mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度 | |
| C. | [浓度1]中a=0.05mol•L-1 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是有毒的气体 | |
| B. | 氯气可以与水反应生成有漂白作用的HClO | |
| C. | 氯气可以与氢氧化钠反应用于尾气的处理 | |
| D. | 实验室用加热分解KClO3的方法制取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质子总数 | B. | 原子总数 | C. | 分子总数 | D. | 质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com