
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 在3S+6KOH=2K2S+K2SO3+3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是1:2 |
分析 A.分散系的分离依据为分散质粒子的直径大小;
B.用饱和食盐水替代水,相当于降低了水的浓度;
C.乙酸乙酯在热的NaOH溶液中会发生水解;
D.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,硫元素由0价降低为-2价,被还原,所以硫既作氧化剂又作还原剂,根据还原产物与氧化产物的化学计量数进行判断.
解答 解:A.分散系的划分是以分散质颗粒大小来区分的,胶体粒子直径介于1nm~100nm之间,溶液溶质粒子直径小于1nm,浊液粒子直径大于100nm,溶液和浊液都不具有丁达尔效应,故A错误;
B.制取乙炔时,用饱和食盐水替代水,相当于降低了水的浓度,可减缓乙炔的产生速率,故B正确;
C.乙酸乙酯在热的NaOH溶液中会发生水解,应用饱和碳酸钠溶液收集产物以除去其中的乙酸,故C错误;
D.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知:作氧化剂的S原子与作还原剂的S原子的物质的量之比为2:1,故D错误;
故选B.
点评 本题考查较为综合,涉及氧化还原反应计算、物质分离与提纯、分散系分类、乙炔的制备等知识,明确氧化还原反应的实质为解答关键,注意掌握物质分离与提纯原则,试题培养了学生的分析能力及灵活应用能力.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则该反应的平均反应速率为( )
A. 0.2mol/(L·s) B. 0.3mol/(L·s) C. 0.1mol/(L·s) D. 0.4mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
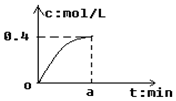 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 5 | B. | 2.5 | C. | 7.5 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑦⑧ | B. | ①③④⑦⑧ | C. | ②⑤⑥⑧⑨ | D. | ①④⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| B. | 纯碱和小苏打都是碱 | |
| C. | 所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应 | |
| D. | 非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2MnO2+2NH4++2e-═2MnO(OH)+2NH3 | B. | Zn-2e-═Zn2+ | ||
| C. | [Zn(NH3)2]2++2e-═Zn+2NH3 | D. | Mn4++e-═Mn3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 70 mL | B. | 60mL | C. | 80 mL | D. | 128 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com