
【题目】防治雾雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(l) PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度/(mol/L) | 2.0×l0-6 | 2.8×10-5 | 3.5×10-5 | 6.0×l0-5 |
则试样的pH为____________。
(2)雾霾的主要成分之一是来自汽车尾气的氮氧化物,研究表明CH4可以消除汽车尾气中氮氧化物的污染。
① CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-889.6KJ/mol
② N2(g)+2O2(g)=2NO2(g)ΔH=+67.2KJ/mol
③ 2NO2(g) ![]() N2O4(g) ΔH=-56.9KJ/mol
N2O4(g) ΔH=-56.9KJ/mol
写出甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:_____。
(3)一定条件下,以CO 和H2合成清洁能源CH3OH,其热化学方程式为CO(g) + 2H2(g) ![]() CH3OH (g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:
CH3OH (g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:
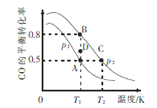
①该可逆反应的ΔH_____0(填“>”“<”“=”)。A,B, C三点对应的平衡常数KA、KB、KC的大小关系是_________。压强:p1_______p2(填“>”“<”“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正________v逆(填“>”“<”“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是__________(填字母)
A. CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2mol CO和4mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2L,则在该条件下反应的平街常数K为______________。
【答案】 4 CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(1) ΔH=-899.9KJ/mol < KA=KB>KC < > AC 1
【解析】(1)根据电荷守恒可知氢离子浓度=(3.5×10-5×2+6.0×l0-5-2.0×l0-6-2.8×10-5)mol/L=10-4mol/L,因此试样的pH为4;(2)已知:① CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-889.6kJ/mol,② N2(g)+2O2(g)=2NO2(g)ΔH=+67.2kJ/mol,③ 2NO2(g) ![]() N2O4(g) ΔH=-56.9kJ/mol,根据盖斯定律①-②-③即得到甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(1) ΔH=-899.9kJ/mol。(3)①升高温度CO转化率降低,说明升高温度平衡向逆反应方向进行,因此该可逆反应的ΔH<0。平衡常数只与温度有关系,则A,B,C三点对应的平衡常数KA、KB、KC的大小关系是KA=KB>KC。正反应体积减小,增大压强平衡向正反应方向进行,转化率增大,则压强:p1<p2。在T1条件下,由D点到B点过程中,转化率升高,反应向正反应方向进行,所以正、逆反应速率之间的关系:v正>v逆。②A. CO的体积分数保持不变说明正逆反应速率相等,达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应达到平衡状态,B错误;C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,C正确;D.单位时间内消耗CO的浓度始终等于生成CH3OH的浓度,D错误,答案选AC。③
N2O4(g) ΔH=-56.9kJ/mol,根据盖斯定律①-②-③即得到甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(1) ΔH=-899.9kJ/mol。(3)①升高温度CO转化率降低,说明升高温度平衡向逆反应方向进行,因此该可逆反应的ΔH<0。平衡常数只与温度有关系,则A,B,C三点对应的平衡常数KA、KB、KC的大小关系是KA=KB>KC。正反应体积减小,增大压强平衡向正反应方向进行,转化率增大,则压强:p1<p2。在T1条件下,由D点到B点过程中,转化率升高,反应向正反应方向进行,所以正、逆反应速率之间的关系:v正>v逆。②A. CO的体积分数保持不变说明正逆反应速率相等,达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应达到平衡状态,B错误;C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,C正确;D.单位时间内消耗CO的浓度始终等于生成CH3OH的浓度,D错误,答案选AC。③
CO(g) + 2H2(g)![]() CH3OH (g)
CH3OH (g)
起始量(mol) 2 4 0
转化量(mol) 1 2 1
平衡量(mol) 1 2 1
三种物质的浓度分别是(mol/L)0.5、1、0.5,所以在该条件下反应的平街常数K为![]() 。
。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为V形的极性分子 B. ClO3﹣的空间构型为平面三角形
C. SiF4和SO32﹣的中心原子均为sp2杂化 D. SF6中有6对相同的成键电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物是指具有(C5H8)n通式以及其含氧和不同饱和程度的衍生物,可以看成是由异戊二烯或异戊烷以各种方式连结而成的一类天然化合物。在于动植物体内广泛存在a、b、c三种物质,下列说法正确的是

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a和b 均可以发生加成反应和氧化反应
D. b和c互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2==2CO2+4H2O。下列说法不正确的是
A. 左边的电极为电池的负极,a处通入的是甲醇
B. 每消耗3.2 g氧气转移的电子为0.4 mol
C. 电池负极的反应式为:CH3OH + H2O 6e===CO2+ 6H+
D. 电池的正极反应式为:O2+2H2O+4e===4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 mL浓度为0.05 mol/L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol/L的NaXO4溶液完全反应。溶液中XO4-被还原为较低价态,则X元素的化合价变为
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 以非极性键结合起来的双原子分子一定是非极性分子
B. 以极性键结合起来的分子一定是极性分子
C. 非极性分子只能是双原子单质分子
D. 金属银晶体为面心立方最密堆积,其配位数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH =b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)= _。

(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com