
硒(34Se)元素是人体必需的微量元素,它在自然界有六种核素。下列有关78Se和80Se的说法不正确的是
A.两者的质量数不同
B.两者的中子数不同
C.两者的核外电子数相同
D.两者互为同素异形体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届宁夏石嘴山三中高三下四模理综化学试卷(解析版) 题型:填空题
【化学——选修3物质结构与性质】
原子序数依次增大的四种元素A、B、C、D依次处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,用最简式表示该晶胞的空间利用率 。
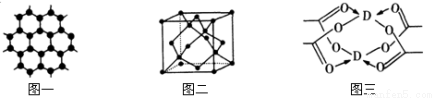
(4)D元素形成的单质,其晶胞内D原子的配位数为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)D元素形成的单质,既不溶于氨水也不溶于双氧水,但溶于两者的混合溶液。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:填空题
为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)等的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H2=-586.7kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
Ⅱ.(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。写出该过程中产生NO的离子方程式: 。
(3)用电化学处理含NO3-的废水,电解的原理如图1所示。则电解时阴极的电极反应式为 ;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。

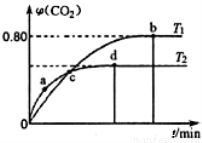
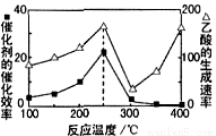
图1 图2 图3
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(4)T1时,该反应的化学平衡常数的数值为 。
(5)下列说法不正确的是_______(填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)
CH3COOH(g) △H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(6)①250~300℃时,乙酸的生成速率减小的主要原因是 。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:填空题
己知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
N2(g)+3H2(g) 2NH3(g)△H=-92.60kJ/mol
2NH3(g)△H=-92.60kJ/mol
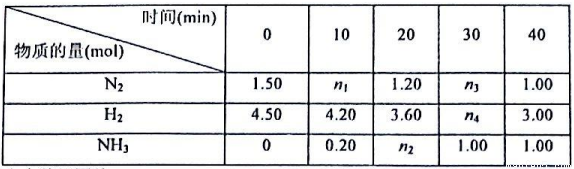
根据表中数据回答:
(1)反应进行到20min时放出的热量为__________kJ。
(2)0-10min内的平均反应速率v(N2)为__________mol/(L·min)
(3)此温度下该逆反应的化学平衡常数K(逆)=__________(保留两位小数).
(4)反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将__________(填“正向移动”或“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:选择题
常温下,下列叙述正确的是:
A.K2CO3溶液中,1/2c(K+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.某浓度的NaAc溶液的pH=8,则该溶液中的c(Na+)-c(Ac-)=9.9×10-7mol/L
C.物质的量浓度相等的①NH4Cl、②(NH4)2SO4两种溶液,c(NH4+)大小顺序为:①>②
D.10mLpH=12的烧碱溶液中加入pH=2的酸HA至中性,所需酸溶液的体积V≥10mL
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:填空题
一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
反应2:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应3:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图l所示。反应1、3的活化能如图2所示。
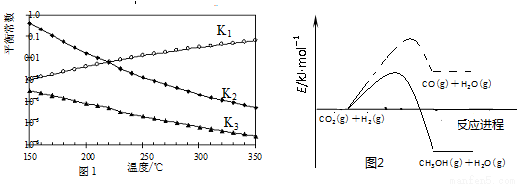
(1)则ΔH2________ΔH3(填“大于”、“小于”或“等于”),理由是________。
(2)反应1中ΔS1______0(填>、=或<=),指出有利于自发进行的温度条件____(填“较高温度”或:“较低温度”)
(3)将体积比为1:1的H2和CO2充入容积可变密闭容器内,若只进行反应1,下列措施中能使平衡时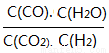 增大的是____________(填序号)
增大的是____________(填序号)
A.升高温度B.增大压强C.充入一定量的CO2 D.再加入一定量铁粉
(4)为了提高CO2和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是____________
(5)在温度为300℃时,使-定量合适体积比为的H2和CO2在体积恒定的密闭容器内进行反应。该温度下反应2进行程度很小可看成不进行,请在图3中画出CO、CH3OH浓度随时间变化至平衡的定性曲线图。

查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,m、n均为正整数,下列说法正确的是
A.离子半径:Rn+>Zm-
B.若Y的最高价氧化物对应的水化物HnYOm为强酸,则X的氢化物沸点一定比Y的氢化物的沸点低
C.若X的气态氢化物能使湿润的石蕊试纸变蓝,则标准状况下,18g Y的氢化物的体积为2.24 L
D.若R(OH)n为弱电解质,则W(OH)n+1可与KOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中文科化学试卷(解析版) 题型:选择题
我国是一个淡水资源比较匮乏的国家,右图是海水淡化原理的一种示意图,符合此原理的方法称为

A.蒸馏法 B.电渗析法
C.离子交换法 D.太阳能蒸发法
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:填空题
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
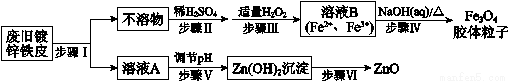
已知:Zn及其化合物的性质与Al及其化合物的性质相似,如:Zn既能溶于强酸又能溶于强碱溶液。
回答下列问题:
(1)步骤I中所用的试剂可以是_________。
(2)步骤III中加入H2O2的作用是做______________。(填“还原剂”或“氧化剂”)
(3)步骤V可选用的试剂是_______(填序号)。
a.NaOH溶液 b.氨水 c.适量HCl溶液
(4)步骤VI的实验操作是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com