
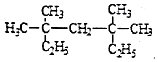 系统命名法为3,3,5,5-四甲基庚烷;
系统命名法为3,3,5,5-四甲基庚烷;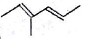 表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;
表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;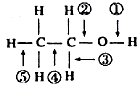
分析 (1)该有机物为烷烃,选取最长碳链为主链,然后结合烷烃命名原则写出其名称;
(2) 为二烯烃,将以键线式表示的有机物改写成结构简式和结构式的形式时,每一个拐点和终点都表示一个C,且省略的原子(如H)必须补充完整;
为二烯烃,将以键线式表示的有机物改写成结构简式和结构式的形式时,每一个拐点和终点都表示一个C,且省略的原子(如H)必须补充完整;
(3)乙醇含有-OH,可发生取代、氧化和消去反应,可与钠反应,结合官能团的性质判断可能的共价键的断裂方式,以此解答;
(4)烯烃为CnH2n,则12n+2n=70,解得n=5;根据该烯烃与氢气加成后得到的烷烃分子中含3个甲基解题.
解答 解:(1)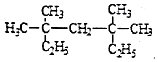 为烷烃,最长碳链含有7个C,主链为庚烷,编号从右边开始,在3号、5号C各含有2个甲基,其名称为:3,3,5,5-四甲基庚烷,
为烷烃,最长碳链含有7个C,主链为庚烷,编号从右边开始,在3号、5号C各含有2个甲基,其名称为:3,3,5,5-四甲基庚烷,
故答案为:3,3,5,5-四甲基庚烷;
(2) 中含有2个碳碳双键,其结构简式为:CH3CH=C(CH3)CH=CHCH3,
中含有2个碳碳双键,其结构简式为:CH3CH=C(CH3)CH=CHCH3,
故答案为:CH3CH=C(CH3)CH=CHCH3;
(3)①乙醇和金属钠反应乙醇钠和氢气,键①断裂,
故答案为:①;
②乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯,反应方程式为CH3CH2OH$→_{△}^{浓硫酸}$CH2═CH2+H2O,故乙醇断键的位置为:②和⑤,
故答案为:②⑤;
③在浓硫酸的催化共热下与乙酸反应生成乙酸乙酯,断裂键①,
故答案为:①;
④在铜或银催化共热下与O2反应生成乙醛和水:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,则断裂①和③,
故答案为:①和③;
⑤和氢卤酸共热时,反应生成卤代乙烷,C-O键断裂,即②键断裂,
故答案为:②.
(4)烯烃为CnH2n,则12n+2n=70,解得n=5,分子式为C5H10;若该烯烃与氢气加成后得到的烷烃分子中含4个甲基,可能的结构简式:CH2=CCH3CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2,
故答案为:C5H10;CH2=CCH3CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.
点评 本题考查较为综合,涉及有机物的结构与性质、有机物命名、同分异构体书写等知识,题目难度中等,注意乙醇的性质与官能团、化学键的关系,明确同分异构体的概念及书写原则,试题知识点较多,充分考查了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核较近的区域内运动 | |
| B. | 凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构 | |
| C. | Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O-O共价键 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | CH3COOH+OH-?CH3COO-+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉生产车间应严禁烟火 | |
| B. | NH3泄露时向空中喷洒水雾 | |
| C. | 含Cl2的尾气用碱溶液处理后再排放 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
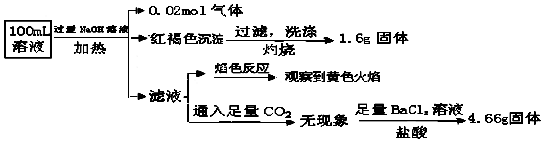
| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com