
 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:| 2.24L |
| 22.4L/mol |
| ||
| ||


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、Cu(OH)2中加入硫酸:OH-+H+=H2O | ||||
| B、Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | ||||
| C、钠加入水中:Na+2H2O=Na++2OH-+H2↑ | ||||
D、向浓盐酸中加二氧化锰:MnO2+4H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 我国工业上主要采用以下四种方法降低尾气中的含硫量:
我国工业上主要采用以下四种方法降低尾气中的含硫量:| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图转化关系:
已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡和硫酸的反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、稀盐酸与石灰石反应:CO32-+2H+=CO2↑+H2O |
| C、用氨水吸收过量的二氧化硫:NH3?H2O+SO2=NH4++HSO3- |
| D、氯化亚铁溶液中加入足量的硝酸:2Fe2++4H++NO3-=2Fe3++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O |
| B、铝片加入烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| C、碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O |
| D、硅酸钠溶液和稀硫酸混合:Na2SiO3+2H+=H2SiO3↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
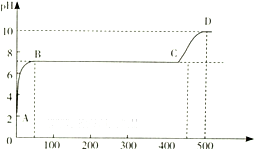
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com