
 .己知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键.
.己知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键. 分析 (1)铁原子失去最外层4s能级2个电子,形成Fe2+,核外电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,电子不同运动状态不同;
(2)NH3分子中氮原子含有孤电子对,BF3分子中B元素不含孤电子对,导致其空间构型不同;根据价层电子对互斥理论确定BF3的分子空间构型;
(3)N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,每个面为正三角形;
(4)离子半径越小,晶格能越大;
(5)Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键;NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子.
解答 解:(1)铁原子失去最外层4s能级2个电子,形成Fe2+,核外电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,Ti元素原子核外有22个电子,所以原子中运动状态不同的电子共有22种,
故答案为:1s22s22p63s23p63d6或[Ar]3d6;22;
(2)NH3分子中氮原子含有孤电子对,NH3中N原子含有3个σ键和1个孤电子对,所以NH3为三角锥构型,为极性分子;BF3中B原子含有3个σ键且不含孤电子对,所以BF3为平面三角形构型;BF3•NH3分子中含有的化学键类型有共价键、配位键,在BF3•NH3中B原子电子对数为$\frac{5+3}{2}$,故杂化方式为sp3,
故答案为:平面正三角形;三角锥型;极性;共价键、配位键;sp3;
(3)N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,每个面为正三角形,N-N 键的键角为60°,故答案为:60°;
(4)离子半径越小,晶格能越大,半径:Na+<K+,则晶格能:NaN3>KN3,故答案为:>;
(5)Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为 ;
;
F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,导致NF3中氮原子核对其孤电子对的吸引能力增强,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,
故答案为:N; ;F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键.
;F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键.
点评 本题是对物质结构的考查,涉及分子结构、杂化轨道、核外电子排布式等,注意理解配位键的有关概念,难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
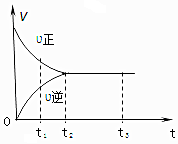 如图是可逆反应:X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应:X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,反应只向正方向进行 | B. | t2时,反应未达到限度 | ||
| C. | t2~t3,反应已停止进行 | D. | t2~t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者分别与少量邻羟基苯甲酸作用,所得产物相同 | |
| B. | 若将二者均配成0.1mol/L的溶液,前者的pH较大 | |
| C. | 分别加入过量盐酸充分反应后,二者产生CO2的体积在标准状况下均为2.24L | |
| D. | 若将二者分别加入1mL水中充分搅拌,恢复至室温后,只有后者有固体剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8×l0-7mol/L | B. | 1.0×l0-5mol/L | C. | 1.0×l0-7mol/L | D. | 1.8×l0-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉一KI试纸检验,观察试纸颜色的变化 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出气体和SO2的体积比为2:3 | |
| C. | 验证淀粉水解产物是否具有还原性,取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀 | |
| D. | 在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,该过程中总反应为2A1+3Ag2S═6Ag+Al2S3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
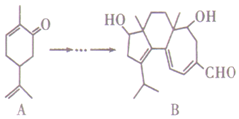 如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )| A. | A的化学式为C10H14O | |
| B. | 与A互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 | |
| C. | A和B均能使酸性KMnO4溶液褪色 | |
| D. | B可以发生加成反应、消去反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)减小 | B. | c(A- )增大 | C. | $\frac{c({H}^{+})}{c(HA)}$增大 | D. | pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com