
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
分析 C6H10O4的不饱和度为$\frac{6×2+2-10}{2}$=2,且能与NaHCO3反应的只含一种官能团,说明分子中含有2个-COOH,2个-COOH的不饱和度为2,说明该有机物分子中不存在其它不饱和结构;该有机物可以看作2个羧基取代丁烷中2个H形成的,丁烷存在正丁烷和异丁烷两种结构,据此解答.
当两个羧基取代正丁烷中2个H时,如图: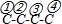 ,两个羧基可以同时在①、②号C,也可以分别在①②、①③、①④、②③号C;当两个羧基取代异丁烷中2个H原子时,
,两个羧基可以同时在①、②号C,也可以分别在①②、①③、①④、②③号C;当两个羧基取代异丁烷中2个H原子时,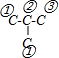 ,两个羧基可以同时在①、③号C,也可以分别在①②、①③、②③号C,据此进行判断满足条件的有机物的同分异构体数目.
,两个羧基可以同时在①、③号C,也可以分别在①②、①③、②③号C,据此进行判断满足条件的有机物的同分异构体数目.
解答 解:C6H10O4的不饱和度为$\frac{6×2+2-10}{2}$=2,且能与NaHCO3反应的只含一种官能团,说明分子中含有2个-COOH,2个-COOH的不饱和度为2,说明该有机物分子中不存在其它不饱和结构;该有机物可以看作2个羧基取代丁烷中2个H形成的,丁烷存在正丁烷和异丁烷两种结构,
当两个羧基取代正丁烷中2个H时,如图: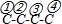 ,两个羧基可以同时在①、②号C,也可以分别在①②、①③、①④、②③号C,总共有6种结构;
,两个羧基可以同时在①、②号C,也可以分别在①②、①③、①④、②③号C,总共有6种结构;
当两个羧基取代异丁烷中2个H原子时, ,两个羧基可以同时在①号C,也可以分别在①②、①①号C,总共有3种结构;
,两个羧基可以同时在①号C,也可以分别在①②、①①号C,总共有3种结构;
所以符合条件的有9种,故选C.
点评 本题考查了同分异构体的书写,题目难度中等,明确同分异构体的书写原则为解答关键,注意掌握常见有机物结构与性质,试题培养了学生的分析能力及逻辑推理能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 符合的条件 | 序号 |
| 1 | 电解质 | |
| 2 | 非电解质 | |
| 3 | 强电解质 | |
| 4 | 弱电解质 | |
| 5 | 既不是电解质也不非电解质 | |
| 6 | 能导电的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7gAl原子变成离子时,失去电子数为0.1NA | |
| B. | 22.4LCH4 所含的电子数为10NA | |
| C. | 20℃1.01×105Pa时,28gN2所含的原子为NA | |
| D. | 20℃1.01×105Pa时,11.2LO2所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH4 | |
| B. | 存在于污水中的细菌,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO═3Mg+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
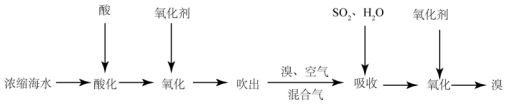
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由 Al、Cu、稀 H2SO4 组成原电池,放电时 SO42-向 Al 电极移动 | |
| B. | 由 Mg、Al、NaOH 溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由 Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出 1 mol Ag时,消耗铜电极32 g | |
| D. | 由 Fe、Cu、FeCl3 溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③④ | C. | ①③⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com