
| A. | ①②③ | B. | ②③⑤ | C. | ④⑤ | D. | ④⑤⑥ |
分析 醋酸是弱酸,加水稀释促进醋酸电离,溶液中c(H+)、c(CH3COO-)都减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大.
解答 解:①醋酸是弱酸,加水稀释促进醋酸电离,水的电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,故①错误;
②加水稀释促进醋酸电离,导致溶液中n(H+)增大,故②正确;
③加水稀释促进醋酸电离,则N(H+)增大、N(CH3COOH)减小,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故③正确;
④根据③知,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$减小,故④错误;
⑤加水稀释促进醋酸电离,溶液中c(H+)、c(CH3COO-)都减小,温度不变,水的离子积不变,则溶液中c(OH-)增大,故⑤正确;
⑥加水稀释促进醋酸电离,水的电离增大程度小于溶液体积增大程度,所以溶液中c(CH3COO-)减小,故⑥错误;
故选B.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,根据醋酸电离程度与溶液体积增大程度之间的关系结合水的离子积常数来分析解答,很多同学往往认为“增大醋酸电离程度,则溶液中氢离子浓度增大”而导致错误,为易错点题.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
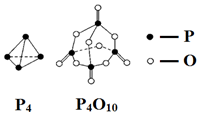
| A. | -(6a-12b-4c+5d)kJ•mol-1 | B. | -(-6a+12b+4c-5d)kJ•mol-1 | ||
| C. | -(-4a+6b+4c-5d)kJ•mol-1 | D. | -(4a-6b-4c+5d)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 食盐中添加碘酸钾(KIO3)加工碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A. | 碱 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 碱 | 酚酞 | 甲 |
| C. | 碱 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
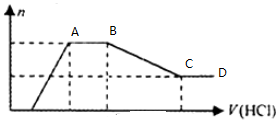
| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com