
相同温度、相同物质的量浓度的下列各组溶液,按pH值依次减小的顺序排列的是( )
A、CH3COONa、Na2CO3、NaHSO4、NaCl B、HCl、CH3COOH、NH4Cl、NaHCO3
C、NaOH、Ba(OH)2、H2SO4、HCl D、NH4Cl、CH3COOH、NaHSO4、H2SO4
科目:高中化学 来源: 题型:阅读理解
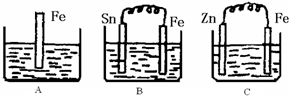
 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
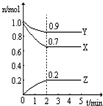
| 16 |
| 3 |
| 容器 | 容器1 | 容器2 | 容器3 |
| 反应物投入量(始态) | 1molCO2、3molH2 | 0.5molCO2、1.5molH2 | 1molCH3OH、1molH2O |
| CH3OH的平衡浓度/mol?L-1 | c1 | c2 | c3 |
| 平衡时体系压强/Pa | p1 | p2 | p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下,发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g ) △H<0 ,
2NH3(g ) △H<0 ,
反应中NH3的物质的量浓度变化情况如右图:
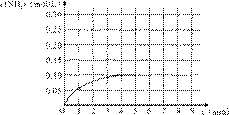
(1)根据上图,计算从反应开始到平衡时,平
均反应速率v(NH3)为______mol/(L·min)。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为___________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡___________________移动(填“向逆反应方向”、“向正反应方向”或“不”)。
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
(A)图Ⅰ可能是不同压强对反应的影响,且P2>P1
(B)图Ⅱ可能是不同压强对反应的影响,且P1>P2
(C)图Ⅲ可能是不同温度对反应的影响,且T1>T2
(D)图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com