
 有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.
有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.分析 (1)170℃时:乙醇中C-O键和连接醇羟基的碳原子相邻碳原子上的H原子脱去而发生消去反应;
(2)140℃时,一个乙醇分子中醇羟基上的O-H键断裂、另一个乙醇分子中C-O键断裂而发生取代反应;
官能团决定物质性质,乙醇的性质取决于乙醇的官能团.
解答 解:(1)170℃时:乙醇中C-O键和连接醇羟基的碳原子相邻碳原子上的H原子脱去而发生消去反应,即②⑤键断裂,反应类型是消去反应;
故答案为:②;⑤;消去;
(2)140℃时,一个乙醇分子中醇羟基上的O-H键断裂、另一个乙醇分子中C-O键断裂而发生取代反应,即①②断裂,反应类型是取代;
官能团决定物质性质,乙醇的性质取决于乙醇的官能团,乙醇的官能团是醇羟基,则决定乙醇主要化学性质的基团是醇羟基,
故答案为:①;②;取代;醇羟基.
点评 本题考查有机物结构和性质,为高频考点,官能团决定性质,侧重考查学生对反应类型的理解和掌握,注意其断键和成键方式,题目难度不大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:多选题
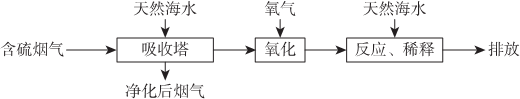
| A. | 天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F、Cl、Br、I最高正化合价都为+7 | |
| B. | 卤族元素的单质只有氧化性 | |
| C. | 从F到I,原子的得电子能力依次减弱 | |
| D. | 卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
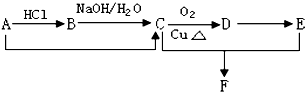
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向汽油中添加乙醇后,该混合燃料的热值不变,但可以达到减排的目的 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 光导纤维、氧化铝陶瓷、PE、硅藻土都是无机非金属材料,橡胶、酚醛树脂都是人工合成高分子材料 | |
| D. | 泡沫灭火器是常见灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液,外筒为金属材质,内外筒之间盛装硫酸铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH}{→}$Na2SiO3(aq) | |
| B. | CuO$→_{△}^{H_{2}}$Cu$\stackrel{稀硫酸}{→}$CuSO4(aq) | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| D. | NaCl饱和溶液$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
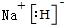 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com