
| A. | ①③⑤ | B. | ②③④ | C. | ②⑥ | D. | ①③⑥ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①混合气体的密度不变,说明气体的质量不变,反应达平衡状态,故正确;
②两边气体计量数相等,混合气体的压强始终不变,故错误;
③C(g)的物质的量浓度不变,说明正逆反应速率相等,反应达平衡状态,故正确;
④、当体系达平衡状态时,容器内A、C、D三种气体的浓度之比可能为2:1:1,也可能不是,故错误;
⑤单位时间内生成n molC,同时生成n mol D,都体现正方向,未说明正与逆的关系,故错误;
⑥单位时间内生成n molD等效于消耗2n mol A,的同时生成2n mol A,正逆反应相等,达平衡状态,故正确;
故选:D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:多选题
| A. | 能够便甲基橙变黄的溶液一定为碱性溶液 | |
| B. | 以KI溶液为标准溶液滴定未知浓度的FeCl3溶液,可选用淀粉溶液作为指示剂 | |
| C. | 使用量程为50mL的滴定管测量溶液体积时,开始时读数为21.00mL,将滴定管中剩余液体全部放出,则所得溶液体积大于29.00mL | |
| D. | 盛待测定的滴定管,第一次读数平视凹液面最低处,第二次仰视,则所测待测液浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5,4,3 | B. | 4,4,3 | C. | 4,3,3 | D. | 3,3,3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+Cl-CO32- Cu2+ | B. | Na+Cl-K+ SO42- | ||
| C. | SO42- Mg2+ Ba2+ Cl- | D. | Na+Cl-K+ HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
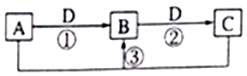 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )| A. | X、Y、Z元素的离子半径大小是X>Y>Z | |
| B. | x元素的氢化物沸点比同主族元素的氢化物低 | |
| C. | Y与Q和W与Q元素形成的化合物化学键类型相同 | |
| D. | q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
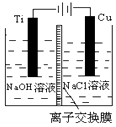 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能 | |
| B. | 化学反应不一定都有能量变化 | |
| C. | 活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响 | |
| D. | 活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com