
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原于半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
科目:高中化学 来源:不详 题型:单选题
| A.铯与冷水反应十分平缓并生成H2 |
| B.铯与硫酸反应,生成CsSO4与H2 |
| C.铯的氧化物可直接与水反应生成CsOH |
| D.铯在空气中燃烧生成Cs2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
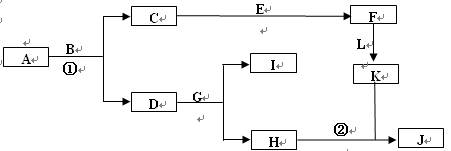
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 电离能/kJ·mol—1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
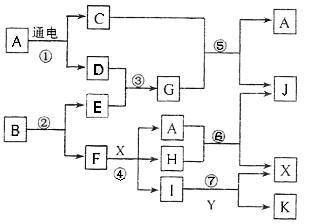
 请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。
请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
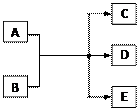
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com