
| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 1L 0.1mol•L-1AlC13中所含Al3+离子数小于0.1NA | |
| C. | 1LpH=1的H2SO4溶液中含有的H+数为0.2NA | |
| D. | 常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
分析 A.铁在氧气中燃烧生成四氧化三铁,铁化合价为+$\frac{8}{3}$价;
B.A13+为弱碱阳离子,在溶液中会水解;
C.pH=1的H2SO4溶液,C(H+)=0.1mol/L;
D.氨气与氯化氢反应生成氯化铵固体.
解答 解:A.Fe物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,在氧气中燃烧,完全反应时转移电子数为$\frac{0.8}{3}$NA,故A错误;
B.A13+为弱碱阳离子,在溶液中会水解,n(AlC13)=1L×0.1mol•L-1AlC13=0.1mol,故铝离子的个数为0.1NA个,溶液中的铝离子的个数小于0.1NA,故B正确;
C.1LpH=1的H2SO4溶液中含有的H+数为0.1mol/L×1L×NA=0.1NA,故C错误;
D.常温下,1.7gNH3和3.65gHCl混合后反应生成0.1mol氯化铵,氯化铵为固体,不含气体分子,故D错误,
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意氯化铵常温下状态,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 | |
| B. | 称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| C. | 称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| D. | 用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
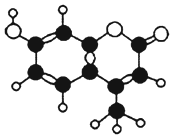 可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )
可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )| A. | ①③⑤ | B. | ③④⑤ | C. | ③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “神州七号”的防护层中含聚四氟乙烯,制备聚四氟乙烯的单体属于不饱和烃 | |
| B. | 聚乳酸是常用的微生物降解高分子:合成纤维、人造纤维统称化学纤维 | |
| C. | 铁是生活中常用的金属,在一些反应中可作催化剂 | |
| D. | 回收地沟油制造生物柴油符合环境保护的要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2都能与水反应生成相应的酸 | |
| B. | 硅可以用做半导体材料,SiO2可用于制光导纤维 | |
| C. | 氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中 | |
| D. | 玻璃是人类最早使用的硅酸盐材料,玻璃加热熔化时有固定的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| B. | 海水淡化的方法有蒸馏法、离子交换法和电渗析法等 | |
| C. | 用乙醚从黄花蒿中提取青蒿素利用了萃取原理 | |
| D. | 水泥厂常用高压电除去工厂烟尘,利用了胶体的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com