
[化学—选修3:物质结构与性质](15分)
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子。
(1)写出基态E原子的价电子排布式 。
(2)B、C、D三种元素第一电离能由小到大的顺序为 (用元素符号表示)。
(3)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式 。
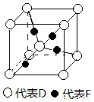
(4)A2D的沸点在同族元素中最高,其原因是 。A2D由液态形成晶体时密度 (填“增大”、“不变”或“减小”),其主要原因 (用文字叙述)。
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为 (用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g·cm-3(用含a、NA的符号表示)。
(1)3d54s1 (2)C<O<N
(3)sp3杂化 三角锥形 
(4)由于水分子间形成氢键,导致沸点升高 减小 水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小
(5)Cu2O 
【解析】
试题分析:在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,B的一种核素在考古时常用来鉴定一些文物的年代,则B为C,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,则C为N,D为O,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,则E为Cr,F元素位于周期表的ds区,其基态原子最外能层只有一个电子,则F为Cu,A与其余五种元素既不同周期也不同主族, 则A为H。
(1)由以上推断可知E原子为24号Cr原子,其原子的价电子排布式3d54s1 ,
(2)B、C、D三种元素分别为C、N、O,根据同周期,第一电离能的变化规律,氮原子的P轨道是半充满状态,原子较稳定,第一电离能由小到大的顺序为C<O<N
(3)NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形,N2和CO是等电子体,根据等电子体原理,C、O之间有3对共用电子对,所以化合物CO的电子式为
(4)由于水分子间形成氢键,导致沸点升高,所以H2O的沸点在同族元素中最高,水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小,所以H2O由液态形成晶体时密度减小。
(5)D、F分别为O、Cu,氧原子个数为8×1/8+1=2,铜原子个数为4×1=4,则该化合物的化学式为Cu2O,该晶胞有4个Cu,2个O,则1mol晶胞的质量为64×4+16×2=288g,则一个晶胞的质量为m=288/NA,
相邻氧原子和铜原子间的距离为a cm,则该晶胞的体积为64a3/(3×30.5)=  .
.
考点:考查元素的推断,基态原子核外电子排布,sp杂化的类型,晶胞密度的计算等知识.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:选择题
X、Y、Z、M、W五种短周期元素。X的质子总数与电子层数相同,Y、Z、M、W在周期表中的相对位置如下表,且W原子核外电子数是M原子最外层电子数的2倍。下列说法不正确的是
Y | Z | M | |
W |
A.原子半径:W>Y>Z>M>X
B.X、Y、Z 三种元素形成的化合物中可能既有离子键又有共价键
C.W分别与M、Z元素形成的化合物WM4、WZ2都是原子晶体
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:实验题
(15分)TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)==TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下

有关性质如下表
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通入氮气;反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解TiOSO4(aq)+ 2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
下列实验能达到实验目的的是
A.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
B.向做完蔗糖水解后的溶液中直接加入新制的Cu(OH)2并加热,以检验蔗糖是否水解
C.将混有HCl的CO2通入饱和Na2CO3溶液中除去HCl
D.将Al2(SO4)3溶液蒸干制备Al2(SO4)3固体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:选择题
根据下列各图曲线表征的信息,得出的结论不正确的是

A.图1表示常温下向体积为10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C.图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:填空题
选考[化学—有机化学基础](13分)

(1)可鉴别风信子醛和突厥酮的试剂是 。
(2)下列关于风信子醛和突厥酮的说法中正确的是 (填序号)。
a.都属于芳香族化合物 b.都能使酸性高锰酸钾溶液褪色
c.突厥酮的分子式为C13H20O d风信子醛不能发生加成反应
(3)突厥酮与嗅水反应的化学方程式为 。
(4)芳香烃A发生如下反应生成F:

F与冬青油互为同分异构体。请回答:
①若A的分子式为C10 H14,则能实现上述转化的A的同分异构体有 种
②C→D的反应类型为 。
③设汁C→D和E→F步骤的目的为 。
④F生成高聚物的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月教学质量检查理综化学试卷(解析版) 题型:选择题
某研究小组测定不同温度下、不同初始浓度的某溶液中R的水解速率,c(R)随时间的变化曲线,如图。下列说法不正确的是

A.在0-6min之间,25℃时R的水解速率为0.05 mol·L—1·min—1
B.在0-24min之间,曲线3对应水解速率最小
C.由曲线1可以得出结论:其它条件不变,水解速率随浓度增大而增大
D.由曲线2、3可以得出结论:其它条件不变,水解速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市等三校高二上学期期末化学试卷(解析版) 题型:填空题
(10分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为_____________。
(2)丙池中F电极为________(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的化学方程式为____________________________________________________________。
(3)当乙池中C极质量减轻4.32 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是________(填字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com