
| A. | 10 mL0.1 mol•L-1氨水与10 mL0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL0.1 mol•L-1NH4Cl溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL0.1 mol•L-1CH3COOH溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
分析 A.等物质的量的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(OH-)<c(H+),再结合电荷守恒判断c(Cl-)、c(NH4+)相对大小;
B.等物质的量的氯化铵和NaOH溶液混合,二者恰好反应生成等物质的量浓度的NaCl、NH3.H2O,一水合氨电离导致溶液呈碱性,但电离程度较小;
C.等物质的量的醋酸和NaOH溶液混合,二者恰好反应生成醋酸钠,醋酸根离子水解导致溶液呈碱性;
D.10 mL0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,溶液中溶质为CH3COOH、NaCl和HCl,且醋酸和氯化钠浓度相等,是盐酸浓度的5倍.
解答 解:A.等物质的量的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(OH-)<c(H+),再结合电荷守恒得c(Cl-)>c(NH4+),铵根离子水解程度较小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.等物质的量的氯化铵和NaOH溶液混合,二者恰好反应生成等物质的量浓度的NaCl、NH3.H2O,一水合氨电离导致溶液呈碱性,则存在c(OH-)>c(H+),根据物料守恒得c(Na+)=c(Cl-),一水合氨电离程度较小,所以离子浓度大小顺序是c(Na+)=c(Cl-)>c(OH-)>c(H+),故B正确;
C.等物质的量的醋酸和NaOH溶液混合,二者恰好反应生成醋酸钠,醋酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒得c(Na+)>c(CH3COO-),所以离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.10 mL0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,溶液中溶质为CH3COOH、NaCl和HCl,且醋酸和氯化钠浓度相等,是盐酸浓度的5倍,醋酸和HCl电离导致溶液呈酸性,所以c(OH-)<c(H+),根据物料守恒得c(Cl-)>c(Na+),醋酸电离程度较小,所以离子浓度大小顺序是c(Cl-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确混合溶液中溶质成分及其性质是解本题关键,注意结合电荷守恒、物料守恒来分析解答,题目难度不大.


科目:高中化学 来源: 题型:填空题
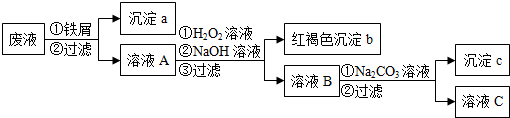
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
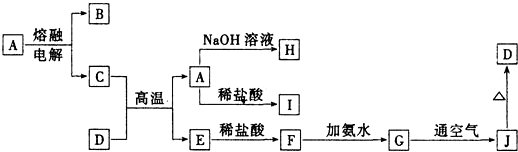
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 定容后,塞好瓶塞,反复倒转、摇匀 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
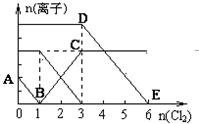 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe2+物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=3 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X是形成化合物类最多,它一气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成一化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气来源 |
| V | V的单质是淡黄色固体,是黑火药一主要成分 |
| W | 日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
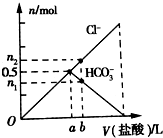 向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )
向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )| A. | 0a段反应的离子方程式为:CO32-+H+=HCO3- | |
| B. | 原Na2CO3溶液中含有0.5mol Na2CO3 | |
| C. | b点时生成的CO2的物质的量为0.1 mol | |
| D. | b点时HCO3-物质的量为0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com