
| A、工业上冶炼Fe用热还原方法 |
| B、海水淡化的方法主要有蒸馏法,电渗析法,离子交换法等 |
| C、工业上通过煤的干馏可获得芳香烃 |
| D、单质硅是将太阳能转变为电能的材料,二氧化硅可以做半导体材料 |


科目:高中化学 来源: 题型:
| 25℃平衡体系(苯、水HA) | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA?H++A- | K1 | △H1 | 3.0×10-3mol?L-1 |
| 在苯中,2HA?(HA)2 | K2 | △H2 | 4.0×10-3mol?L-1 |
| c[(HA)2] |
| c2(HA) |
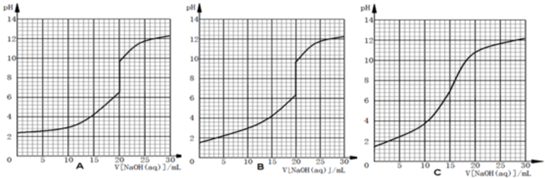
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,C12可在甲苯的苯环或侧链上发生取代反应 |
B、2-甲基丙烯的结构简式: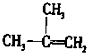 |
| C、乙醇和乙烯的混合物l mol,完全燃烧消耗3 mol O2 |
| D、光照下2,2-二甲基丁烷与Br2反应,其一溴取代物只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B、氢氧燃料电池是一种将化学能转化为电能的装置 |
| C、可用浸有酸性高锰酸钾溶液的滤纸来检验二氧化硫气体的漂白性 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: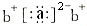 .下列叙述正确的是( )
.下列叙述正确的是( )| A、原子半径:a>c>d |
| B、非金属性:c>a>d |
| C、相应氢化物的沸点:d>c>a |
| D、c与a、c与b均能形成两种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电负性用来描述不同元素的原子对键合电子吸引力的大小 |
| B、电负性是以氟为4.0、锂为1.0作为标准的相对值 |
| C、元素电负性越小,元素非金属性越强 |
| D、元素电负性越大,元素非金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L溶液中阴阳离子总数为1.2NA |
| B、500 mL溶液中NO3-浓度为0.2 mol/L |
| C、500 mL溶液中Ba2+浓度为0.2 mol/L |
| D、500 mL溶液中NO3-物质的量为0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com