
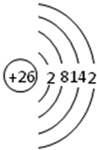
 .
.分析 (1)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,根据原子结构示意图的书写规则书写;
(2)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,写出相应的元素符号;
(3)根据原子的外围电子排布是4s24p4,确定该原子名称;
(4)1molSi中含有2molSi-Si,1molSiO2含有4molSi-O键,△H=反应物的键能和-生成物的键能和;
(5)计算氧原子的价层电子数与氧原子的孤对电子对数,判断杂化方式与水合氢离子的空间构型,计二氧化硫中硫原子的价层电子数与氧原子的孤对电子对数,确定其空间结构;
(6)能形成氢键的原子为N、O、F和氢原子之间,氢键是分子之间的相互作用力.
解答 解:(1)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,所以当另一个3p轨道上没有电子,该原子是Si;一种是另一个3p轨道上充满电子,该原子是S,故答案为:Si或S;
(3)原子的外围电子排布是4s24p4,说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,故答案为:硒;
(4)△H=反应物的键能和-生成物的键能和=2×175KJ/mol+498KJ/mol-4×460KJ/mol=-892KJ/mol,故答案为:-892KJ/mol;
(5)二氧化硫分子是O原子价层电子对2+$\frac{1}{2}$(6-2×2)=3,氧原子孤对电子对数为1,氧原子采取sp2杂化,二氧化硫分子中硫原子价层电子对2+$\frac{1}{2}$(6-2×2)=3,氧原子孤对电子对数为1,空间构型为V形;
水合氢离子中氧原子的价层电子对3+$\frac{1}{2}$(6-1-3×1)=4,氧原子孤对电子对数为1,氧原子采取sp3杂化,水合氢离子空间构型为三角锥型,
故答案为:sp2;sp3;V形;三角锥型;
(6)N、O、F和氢原子之间能形成氢键,F的氢化物溶液剂为氢氟酸的水溶液,含有HF分子以及H2O分子,存在的所有氢键为F-H…F、F-H…O、O-F…F、O-H…O,
故答案为:F-H…F、F-H…O、O-F…F、O-H…O.
点评 本题考查结合性质位置关系、核外电子排布、杂化理论与分子构型、键能等,题目综合性较大,侧重对基础知识的巩固,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:
X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
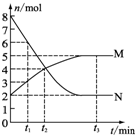 一定温度下,在容积为V L的密闭容器中进行aN(g)?bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行aN(g)?bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题: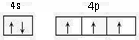 ,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.
,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
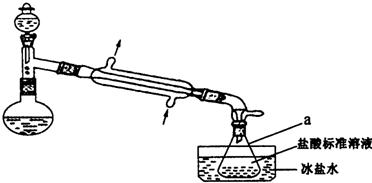 某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验:
某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
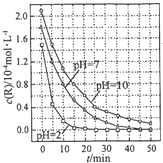
| A. | 在0-50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 | |
| B. | 溶液酸性越强,R 的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com