
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 | H-F | 565 | F-F | 158 |
| H-H | 436 | H-N | 391 |
分析 (1)①(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;根据2g甲醇燃烧生成CO2和液态水时放热45kJ,计算1mol甲醇燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
②根据每生成23克NO2需要吸收17kJ热量,计算2molNO2燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(2)①旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,依据化学反应的焓变=反应物总键能-生成物总键能计算得到反应的焓变;
②1molN2含有1molN≡N,1molH2含有1molH-H,1molNH3含有3molN-H,依据△H=反应物的总键能-生成物的总键能进行计算.
(3)①依据反应物和生成物配平书写化学方程式,根据定律关系判断,0.4mol液态肼和0.8mol H2O2混合恰好反应,所以1mol液态肼完全反应放出641.75kJ的热量;
②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律计算分析得到.
解答 解:(1)①在25℃、101kPa下,2g甲醇(CH3OH)燃烧生成CO2和液态水时放热45kJ,32g甲醇燃烧生成CO2和液态水时放热22.5kJ×32=720kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热720KJ,所以燃烧热的热化学方程式为:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-720kJ/mol,故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-720kJ/mol;
②适量的N2和O2完全反应,每生成23克NO2需要吸收17kJ热量,所以每生成92克NO2需要吸收68kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,
故答案为:N2(g)+2O2(g)═2NO2(g)△H=+68kJ/mol;
(2)①化学反应的焓变=反应物总键能-生成物总键能,CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=(414KJ/mol×4+158KJ/mol×4)-(489KJ/mol×4+565KJ/mol×4)=-1928KJ/mol;
故答案为:-1928KJ/mol;
②已知:H-H键能为436kJ/mol,N-H键键能为391kJ/mol,令N≡N键的键能为x,
对于反应$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-46kJ/mol,
反应热=反应物的总键能-生成物的总键能,故△H=$\frac{1}{2}$xkJ/mol+$\frac{3}{2}$×436kJ/mol-3×391=-46kJ/mol,解得:x=946kJ/mol,
故答案为:946kJ/mol;
(3)①反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.7KJ的热量,则1mol液态肼放出的热量为$\frac{256.7kJ}{0.4}$=641.75kJ,
所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol;
②①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75KJ/mol:则16g液态肼物质的量=$\frac{16g}{32g/mol}$=0.5mol;与液态双氧水反应生成液态水时放出的热量408.875KJ,
故答案为:408.875.
点评 本题考查热较为综合,为高考常见题型和高频考点,涉及化学方程式的书写,盖斯定律的计算判断,反应热的计算应用,注意盖斯定律的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48gO3含有的氧原子数为NA | |
| B. | 11.2LSO3中含有的SO3分子数为NA | |
| C. | 1.8g的NH4+离子中含有的电子数为NA | |
| D. | 0.1L2mol/LNaCl溶液中含有Na+个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
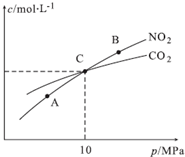 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.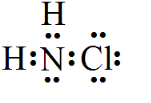 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 结论 |
| A | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 将铜片与锌片用导线连接后,插入稀硫酸中,铜片上有气泡产生 | 在锌的作用下,铜与硫酸反应产生氢气 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度:CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com