
【题目】芳香族化台物肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,其球棍模型如图所示(图中球与球之间的棍代表化学键,如单键、双键等)。其制备过程涉及肉桂醇电解制备肉桂醛,肉桂醛氧化制备肉非酸,再与甲醇酯化制得。下列说法不正确的是

A. 肉桂酸甲酯的分子式为C10H10O2
B. 电解肉桂醇制得的肉桂醛在电解池的阴极生成
C. 1mol肉桂酸甲酯与H2加成最多消耗4mol
D. 肉桂酸甲酯中所有碳原子可能在同一平面内
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)是新型锂离子电池常用的正极材料。工业上以软锰矿浆为原料可制备锰酸锂,同时制得副产品MnSO4·H2O晶体,其流程如图所示。
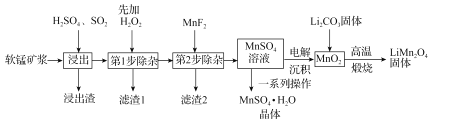
已知:(1)软锰矿浆的主要成分为MnO2,还含有Fe2O3,MgO、Al2O3,CaO,SiO2等杂质。
(2)温度高于27℃时,MnSO4晶体的溶解度随温度升高而逐渐降低。
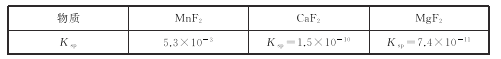
(3)有关物质的溶度积常数如下表:
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为_____。该过程中,为提高软锰矿中MnO2的浸出率,下列措施可行的有_____(填字母)。
A.不断搅拌,使SO2和软锰矿浆充分接触
B.增大通入SO2的流速
C.适当升温
D.减少软锰矿浆的进入量
(2)第1步除杂中加入H2O2的目的是_____。
(3)第2步除杂,主要是将Ca2+,Mg2+转化为相应的氟化物沉淀除去,其中MnF2除去Mg2+反应的离子方程式为MnF2(s)+Mg2+(aq)=Mn2+(aq)+MgF2(s),该反应的平衡常数为_____。
(4)图中的一系列操作指的是_____。
(5)将MnO2和Li2CO3按4:1的物质的量之比配料,混合搅拌,然后高温煅烧600~750℃,制取产品LiMn2O4。写出该反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是
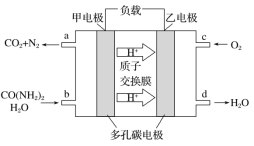
A. 电池工作时H+移向负极
B. 该电池用的电解质溶液是KOH溶液
C. 甲电极反应式:CO(NH2)2+H2O+6e-===CO2+N2+6H+
D. 电池工作时,理论上每净化1 mol CO(NH2)2,消耗标况下氧气33.6 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为MnO2+Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。

(1)Mn2+的核外电子排布式为__;有机高聚物中C的杂化方式为__。
(2)已知CN-与N2互为等电子体,推算拟卤素(CN)2分子中σ键与π键数目之比为__。
(3)NO2-的空间构型为__。
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

Mn的第一电离能是__,O2的键能是__,MnO的晶格能是__。
(5)R(晶胞结构如图)由Zn、S组成,其化学式为__(用元素符号表示)。已知其晶胞边长为a cm,则该晶胞的密度为__g·cm-3(阿伏加德罗常数用NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_____________。
(3)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压强变化不会使下列化学反应的平衡发生移动的是( )
A. C(s)+CO2(g)![]() 2CO(g)B. 3H2(g)+N2(g)
2CO(g)B. 3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
C. 2SO2(g)+O2(g)![]() 2SO3(g)D. H2(g)+I2(g)
2SO3(g)D. H2(g)+I2(g)![]() 2HI(g)
2HI(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列叙述错误的是
A.7.8gNa2O2与过量水反应转移电子数为0.1NA
B.1 mol OD-离子含有的质子、中子数均为9NA
C.46g NO2和N2O4混合气体中含有原子总数为3NA
D.已知N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ·mol﹣1,当有3NA个电子转移时,△H变为﹣46.2kJ·mol﹣1
2NH3(g)△H=﹣92.4kJ·mol﹣1,当有3NA个电子转移时,△H变为﹣46.2kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年中国科学家成功合成NiO/TiO2电解水催化剂和新型高效的钙钛矿太阳能电池,为解决能源危机保护环境作出了重大贡献。请回答下列问题:
(1)TiO2与焦炭、Cl2在高温下反应的化学方程式为:TiO2+2C+2Cl2 ![]() TiCl4+2CO。
TiCl4+2CO。
①基态钛原子的价电子排布式为_________________。
②该反应中涉及到的非金属元素的电负性大小顺序为_______________________。
(2)已知NiO/TiO2催化化合物甲生成化合物乙的过程如图所示:

化合物甲的沸点小于化合物乙的沸点,主要原因是___________________。在化合物乙中,氧原子的杂化方式是______________。
(3)CH3NH3+、Ti4+、Pb2+、Cl-等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+离子中H—N—H键的键角比NH3分子中H—N—H键的键角 ______ (填“大”或“小”),原因是_____________ 。
(4)Sb(锑)和Ga(镓)的卤化物有很多用途。一定条件下将SbCl3与GaCl3以物质的量之比为l:l反应得到一种固态离子化合物,有人提出了以下两种结构。你认为下列关于结构和说法中合理的是 ____ 。
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. 没有相关资料,无法判断
(5)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。

①请回答,金属钛晶胞的结构属于____________。
a. 简单立方 b. 体心立方 c. 面心立方 d. 金刚石型
②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为______________。
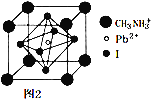
(6)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为d pm、密度为ρ g·cm-3。则该晶体的摩尔质量________ g·mol-1。(用含d、ρ等符号的式子表示,用NA表示阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com