
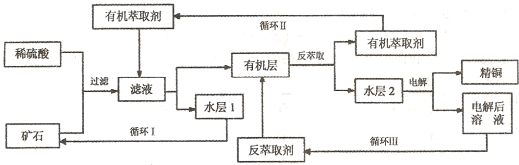
ijͭ��ʯ������ͭ��������ͭ�������������ʹ�����ʯ��SiO2��,�ֲ���������ӿ�ʯ����ȡͭ��������ͼ���£�
��֪�� �ٵ���ʯ����������������̫��ʱ������������������Ļ��Һ����ͭ���ڷ���ȡ���ˮ��������ͭ��Һ��Cu2+Ũ��ԼΪ50g/L���ش��������⣺
��1����ʯ��ϡ�������������������ͭ�����ķ�ӦΪ��Cu2O+2H+===Cu2++Cu+H2O����д���ù����з�������һ��������ԭ��Ӧ�����ӷ���ʽ�� ��
��2��д���ö��Ե缫���ˮ��ĵ���ܷ�Ӧ����ʽ�� ��
��3��ѭ���з���ȡ��B����Ҫ�ɷ��� ��
��4��ijͭ��ʯ��Ʒ�У�������������ͭ����������������ʯ�������ʡ�ȡ�ÿ�ʯ��Ʒ200.0g����100mL1.0mol?L��1H2SO4��Һ��ȡ�������10mL 1.0mol?L��1 Fe2(SO4)3��Һ����ʹͭȫ����������ȡҺ����ֵ���ɵõ� 6.4gCu����ͭ��ʯ��Ʒ��������ͭ��������������������
��12�֣���1��Cu+2Fe3+��2Fe2++ Cu2+��2�֣�
��2��2CuSO4 + 2H2O  O2��+ 2Cu + 2H2SO4��2�֣�
O2��+ 2Cu + 2H2SO4��2�֣�
��3��H2SO4��2�֣� ��4��Cu2O��3.6% ��3�֣� Fe2O3��3.2%��3�֣�
���������������1������ͭ�����������������Ժ�ǿ�ᷢ����Ӧ�����κ�ˮ��CuO+2H+��Cu2++H2O��Fe2O3+6H+��2Fe3++3H2O��������ͭ��������֮����Է���������ԭ��Ӧ����Cu+2Fe3+��2Fe2++Cu2+��
��2�����Ե缫�������ͭ�Ļ�ѧ����ʽ��2CuSO4 + 2H2O  O2��+ 2Cu + 2H2SO4��
O2��+ 2Cu + 2H2SO4��
��3����������ͭ���������ܼ��У�����ѭ���з���ȡ��B����Ҫ�ɷ���ϡ���ᡣ
��4���������ɵ�ͭ��������6.4g�����ʵ�����0.1mol�������ԭ���غ��֪������ͭ�����ʵ�����0.05mol������ͭ��ʯ��Ʒ��������ͭ���������� ��
��
���ݷ���ʽCu2O+2H+��Cu2++Cu+H2O����Ӧ�����ɵ�ͭ��0.05mol�������Cu+2Fe3+��2Fe2++ Cu2+��֪��ͭ��Ӧ����������0.05mol��������0.01L��1.0mol/L��0.01mol���������������ģ�����������ϡ���ᷴӦ���ɵ���������0.04mol���������������ʵ�����0.04mol������������������������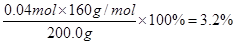 ��
��
���㣺����������ԭ��Ӧ����ʽ����ⷴӦʽ����д����ȡ����ѡ���Լ����ʺ����ļ���
�����������Ǹ߿��еij������ͣ������е��Ѷȵ����⡣�����ۺ���ǿ���������У����ض�ѧ������֪ʶ�Ĺ�����ѵ����ͬʱҲע�ض�ѧ�����������������ͷ���ָ��������������ѧ������˼ά�����ͷ�ɢ˼ά����������������һ���ۺ��Խ�ǿ�����⣬��Ԫ�ؼ����������ʺ�������������������ѧ�����֪ʶ���������ɿ���ѧ���Ի�ѧ֪ʶ������̶ȣ�����Ҫ��������ѧ�����ۺϷ���������˼ά������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
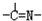 ���ֻ��ţ���״�ṹ�����ֻ��ŵ���Ŀ��ϵΪn3=
���ֻ��ţ���״�ṹ�����ֻ��ŵ���Ŀ��ϵΪn3=

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

 ���ֻ��ţ���״�ṹ�����ֻ��ŵ���Ŀ��ϵΪn3=
���ֻ��ţ���״�ṹ�����ֻ��ŵ���Ŀ��ϵΪn3=�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

 ���ֻ��ţ���״�ṹ�����ֻ��ŵ���Ŀ��ϵΪn3=
���ֻ��ţ���״�ṹ�����ֻ��ŵ���Ŀ��ϵΪn3=�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011��㶫ʡ���ڸ���ѧ�����߿�ǰ���ģ���Ծ������ۣ���ѧ���� ���ͣ�ʵ����
ijͭ��ʯ������ͭ��������ͭ����������������ʯ��SiO2) ���ֲ���������ӿ�ʯ����ȡͭ���乤������ͼ���¡�����ͭ����ȡ��ͭ��ˮ������л���Ĺ��̣��ͷ���ȡ��ͭ���л������ˮ��Ĺ��̣����ִ�ʪ����ͭ����Ҫ�����ֶΡ�
��֪����Cu2O+2H+��Cu2++Cu + H2O���ڵ���ʯ����������������̫��ʱ������������������Ļ��Һ����ͭ�� �۷���ȡ���ˮ��2������ͭ��Һ��
�ش��������⣺
(1)��ʯ��ϡ���ᴦ�������з�����Ӧ�����ӷ���ʽΪ��Cu2O+2H+��Cu2++Cu + H2O
�� �����2����
(2)���л����ˮ�����IJ��������� ��ʵ��ʽ��ɴ˲������õ���һ����Ҫ������ ��
(3)��ѭ��I�������ѭ�����ˮ��1���ܼ���ѭ��ʹ�ã����ɷ����һ����Ҫ�������ξ��壬�þ���Ļ�ѧʽ�� ��
(4)д���������У����缫���Ƕ��Ե缫������������Ӧ�ĵ缫��Ӧʽ
(5)��ѭ�����з���ȡ������Ҫ�ɷ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com