
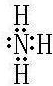 .
.分析 Y元素原子的最外电子层上的电子数是它的电子层数的2倍,则Y可能为He、C、S,由于“短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5”,则Y不可能为S;若Y为He,则Z只能为H元素,X的电子层数=5-1-1=3,最外层电子数=1+2=3,为Al元素,Al与H不会生成化合物XZ3,所以Y为C元素;结合“短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5”可知Z含有1个电子层、X含有2个电子层,则Z为H元素;X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和,则X原子的最外层电子数=4+1=5,则X为N元素,据此进行解答.
解答 解:Y元素原子的最外电子层上的电子数是它的电子层数的2倍,则Y可能为He、C、S,由于“短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5”,则Y不可能为S;若Y为He,则Z只能为H元素,X的电子层数=5-1-1=3,最外层电子数=1+2=3,为Al元素,Al与H不会生成化合物XZ3,所以Y为C元素;结合“短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5”可知Z含有1个电子层、X含有2个电子层,则Z为H元素;X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和,则X原子的最外层电子数=4+1=5,则X为N元素,
(1)由以上分析可知,X为N元素、Y为C元素、Z为H元素,
故答案为:N;C;H;
(2)XZ3为氨气,分子式为:NH3,氨气是共价化合物,分子中含有3个N-H键,其电子式为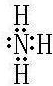 ,
,
故答案为:NH3;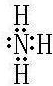 ;
;
(3)X为N元素,N的最高价为+5价,则其最高价含氧酸的分子式为:HNO3 ,
故答案为:HNO3 .
点评 本题考查原子的结构与元素周期律的关系,题目难度中等,试题侧重于原子结构与对应化合物的结构和性质的考查,解答时注意原子的结构特点,为解答该题的关键.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:填空题
 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图所示:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
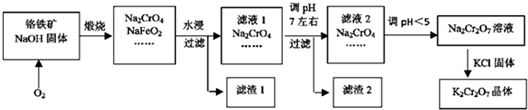
 x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.
x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
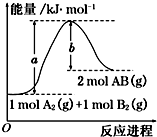
| A. | 该反应热△H=(a-b) kJ•mol-1 | |
| B. | 每生成2 mol AB(g)吸收b kJ能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫黄固体分别完全燃烧,前者放出的热量多 | |
| B. | a℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-2c kJ•mol-1 | |
| C. | 由N2O 4(g)?2NO2(g)△H=-56.9 kJ•mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ | |
| D. | 稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ•mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A和C能形成AC2型的共价化合物 | |
| B. | B的氧化物能与A的最高价氧化物的水化物反应 | |
| C. | 原子半径:B>A,离子半径:C<D | |
| D. | D的单质有毒,且有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烷 | B. | 丙烯(C3H6) | C. | 丁炔(C4H6) | D. | 新戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com