
��2L�ܱ�������ͨ��amol ����A��bmol����B����һ�������·�����Ӧ��xA(g)+yB(g)pC(g)+qD(g)��
��֪��ƽ����Ӧ����vC��1/2vA����Ӧ2min ʱ��A��Ũ�ȼ�����1/3��B�����ʵ���������a/2mol����a mol D���ɡ�
�ش��������⣺
��1����ѧ����ʽ�У�x�� ��y�� ��p�� ��q�� ��
��2����Ӧ2min�ڣ�vA = ��
��3����Ӧƽ��ʱ��DΪ 2amol����B��ת����Ϊ ��
��4����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
| �¶ȡ� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
�÷�Ӧ��ƽ�ⳣ������ʽK=_____________����H________0(���������������=��)��
��5����������������䣬���������ݻ���Ϊ1L������ͬ����ʵ�飬����������Ӧ�Ƚϣ�
�ٷ�Ӧ���� �����������С�����䡱�� ��
��ƽ��ʱ��Ӧ���ת���� �����������С�����䡱����������
��
 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| a |
| 6 |
| a |
| 2 |
| a |
| 12 |
| a |
| 12 |
| a |
| 8 |
| a |
| 8 |
| a |
| b |
| a |
| b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
| a |
| 12 |
| a |
| 12 |
| a |
| 8 |
| a |
| 8 |
| a |
| b |
| a |
| b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2L�ܱ�������ͨ��amol ����A��bmol����B����һ�������·�����Ӧ��xA(g)+yB(g) ![]() pC(g)+qD(g)��
pC(g)+qD(g)��
��֪��ƽ����Ӧ����vC��1/2vA����Ӧ2min ʱ��A��Ũ�ȼ�����1/3��B�����ʵ���������a/2mol����a mol D���ɡ�
�ش��������⣺
��1����ѧ����ʽ�У�x�� ��y�� ��p�� ��q�� ��
��2����Ӧ2min�ڣ�vA = ��
��3����Ӧƽ��ʱ��DΪ 2amol����B��ת����Ϊ ��
��4����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
| �¶ȡ� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010����ݲ��������ѧ�߶���ѧ����ĩ���Ի�ѧ�������� ���ͣ������
(4��) �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��2L�ܱ�������ͨ��2mol ����N2
��6mol����H2����һ�������·�����Ӧ��N2(g)+3H2(g) 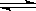 2NH3(g)����֪����Ӧ2min�ﵽƽ�� ����ʱN2��Ũ�ȼ�����2/3��
2NH3(g)����֪����Ӧ2min�ﵽƽ�� ����ʱN2��Ũ�ȼ�����2/3��
�ش��������⣺
�ŷ�Ӧ2min�ڣ���NH3��ʾ�÷�Ӧ��������________________��
�Ʒ�Ӧƽ��ʱ��N2��ת����Ϊ ��
�����ֻ���߷�Ӧ�¶ȣ�������Ӧ�������䣬ƽ��ʱNH3Ũ��Ϊ 1.1 mol/L����÷�Ӧ�Ħ�H 0�����������������������
�Ⱥϳɰ���ҵ��ȡ�����д�ʩ�У���������ɳ����ԭ�����͵���________(�����)��
��20 MPa��50 MPa ��500��ĸ��� ������ý������
�ܽ����ɵİ�Һ������ʱ����ϵ�з��������δ��Ӧ��N2��H2ѭ�����ϳ�����
����������������䣬���������ݻ���Ϊ 1L������ͬ����ʵ�飬����������Ӧ�Ƚϣ�
��Ӧ���� �����������С�����䡱���������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com