
| A. | 钠与盐酸反应最剧烈,产生的氢气最多 | |
| B. | 铝与盐酸反应的速率仅次于钠,产生的气体也没有钠与盐酸反应产生气体多 | |
| C. | 铁与盐酸反应产生的气体比铝与盐酸反应产生的气体多 | |
| D. | 铝与盐酸反应和铁与盐酸反应产生的气体一样多 |
分析 n(Na)=$\frac{3g}{23g/mol}$=$\frac{3}{23}$mol,n(Al)=$\frac{2.7g}{27g/mol}$=0.1mol,n(Fe)=$\frac{9g}{56g/mol}$=$\frac{9}{56}$mol,n(HCl)=0.3×1mol/L=0.3mol,三种金属中钠最活泼,与盐酸反应最剧烈,结合反应的关系式判断反应生成氢气的体积大小.
解答 解:n(Na)=$\frac{3g}{23g/mol}$=$\frac{3}{23}$mol,n(Al)=$\frac{2.7g}{27g/mol}$=0.1mol,n(Fe)=$\frac{9g}{56g/mol}$=$\frac{9}{56}$mol,n(HCl)=0.3×1mol/L=0.3mol,反应关系式依次为Na~HCl、Al~3HCl、Fe~2HCl,
Na+2HCl=NaCl+H2↑,注意计算时以不足的作为计算对象,
1 1
$\frac{3}{23}$ $\frac{3}{23}$
则:钠与盐酸反应生成氢气$\frac{3}{23}$mol≈0.13mol,
2Al+6HCl=2AlCl3+3H2↑
2 3
0.1 0.15
则:铝与盐酸反应生成氢气0.15mol,
Fe+2HCl=FeCl2+H2↑
1 1
$\frac{9}{56}$ $\frac{9}{56}$
则:铁与盐酸反应生成氢气$\frac{9}{56}$ mol≈0.16mol,
A.钠与盐酸反应最剧烈,产生的氢气最少,故A错误;
B.镁与盐酸反应的速率仅次于钠,产生的气体比钠与盐酸反应产生气体多,故B错误;
C.铁与盐酸反应产生的气体比铝与盐酸反应产生的气体多,故C正确;
D.铝与盐酸反应和铁与盐酸反应产生的气体不一样多,故D错误;
故选C.
点评 本题考查常见金属的性质以及方程式的计算,侧重于学生的计算能力的考查,解答本题要注意钠与水的反应,根据各物质的物质的量大小判断反应的过量问题,在答题时不能忽略,难度不大.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | w=$\frac{36.5a}{(36.5a+22400)}$ | B. | w=$\frac{36.5c}{1000b}$ | ||
| C. | C=$\frac{1000ab}{(36.5a+22400)}$ | D. | b=$\frac{(36.5a+22400)}{(a+1)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
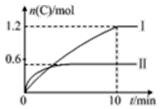 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 上述方程式中a=-160 | |
| B. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾(K2FeO4)是一种新型高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 用SO2漂白纸浆和草帽辫,该过程利用了SO2的氧化性 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp2杂化 | |
| C. | 丙烯分子中最多有7个原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com