
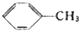
 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$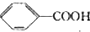
| 名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | 无色液体、易燃、易挥发 | -95 | 110.6 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 112.4(100℃升华) | 248 | 微溶 | 易溶 |
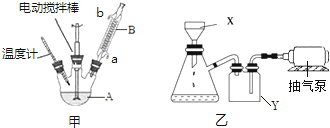
分析 (1)甲苯易挥发,冷凝回流挥发的甲苯;三颈烧瓶所盛液体体积通常占其容积的$\frac{1}{3}$~$\frac{2}{3}$;
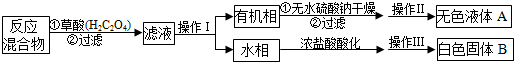
(2)操作I是分离互不相溶的液体采用分液方法;操作Ⅱ用蒸馏的方法控制甲苯沸点得到纯净的甲苯液体;
(3)抽出装置中的空气,形成压强差,使过滤加快;
(4)苯甲酸易升华,可以利用升华进行提纯;
(5)苯甲酸和KOH溶液发生酸碱中和反应,苯甲酸和KOH物质的量相等,进而计算样品中苯甲酸的纯度;
(6)苯甲酸属于弱酸,苯甲酸钾溶液呈碱性,苯甲酸钾溶液中通入二氧化碳,不变浑浊,说明苯甲酸的酸性比碳酸的强.
解答 解:(1)甲苯易挥发,B装置可以冷凝回流挥发的甲苯,减少损失;加入液体总体积约为(100+2.7)mL=102.7mL,三颈烧瓶所盛液体体积通常占其容积的$\frac{1}{3}$~$\frac{2}{3}$,应选择250mL三颈烧瓶,
故答案为:冷凝回流;250;
(2)有机相与水相分层,操作I是将有机相与水相分离,采用分液方法;操作Ⅱ用蒸馏的方法控制甲苯沸点得到纯净的甲苯液体,应将有机相盛放在蒸馏烧瓶中,
故答案为:分液;蒸馏烧瓶;
(3)用抽气泵抽出装置中的空气,形成压强差,抽滤漏斗(即布氏漏斗)中的溶液受压能较快速地通过漏斗孔,这样就达到了加快过滤速度的效果,
故答案为:抽出装置中的空气,形成压强差,使过滤加快;
(4)苯甲酸易升华,利用升华进行提纯最好,其它操作方法容易溶解损失,提纯不彻底,
故答案为:B;
(5)苯甲酸和KOH溶液发生酸碱中和反应,苯甲酸和KOH物质的量相等,则苯甲酸的质量为0.016L×0.5mol/L×122g/mol=0.976g,故产品的纯度为 $\frac{0.976g}{1.00g}$×100%=97.6%,
故答案为:97.6;
(6)取苯甲酸钾溶液,滴入几滴酚酞溶液,溶液变红色,说明苯甲酸为弱酸,将碳酸钠溶液与盐酸反应生成的二氧化碳通入苯甲酸溶液,溶液不浑浊,说明苯甲酸的酸性比碳酸强,
故答案为:取苯甲酸钾溶液,滴入几滴酚酞溶液,溶液变红色,说明苯甲酸为弱酸,将碳酸钠溶液与盐酸反应生成的二氧化碳通入苯甲酸溶液,溶液不浑浊,说明苯甲酸的酸性比碳酸强.
点评 本题考查有机物制备实验、物质的量的分离提纯、实验方案设计、仪器的使用等,是对学生综合能力的考查,(6)中注意苯甲酸微溶于水,苯甲酸与碳酸钠反应现象不明显.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠属于危化品中的易燃固体,其着火时不能用水灭火 | |
| B. | 氰化钠( NaCN)是一种剧毒危险品,其水溶液呈碱性 | |
| C. | 实验室里可将少量的钠保存于煤油中 | |
| D. | NH4N03、NaCN、CaC2中均含有离子键和非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中:K+、Na+、Fe3+、SO42- | |
| B. | 饱和NaHCO3溶液中:Al3+、NO3-、I-、Cl- | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、I-、NO3-、HCO3- | |
| D. | 0.1 mol•L-1FeSO4溶液中:K+、Zn2+、Br-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基(-OH)中所含共价键数 | |
| B. | 1molHCl与KClO3反应生成0.5molCl2转移的电子数 | |
| C. | 1.8 g H2O中所含有的质子数、电子数、中子数 | |
| D. | 常温常压下,22.4LNO和CO混合气体中的O原子个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl和37Cl中子数不同,所以它们的原子结构示意图、电子式、核外电子排布式、轨道表达式都不相同 | |
| B. | 两个不同原子的1s、2s、2p、3s、3P各亚层中电子的能量相同 | |
| C. | 短周期主族元素原子最外层电子数一定等于其最高化合价 | |
| D. | CO2通入Na2SiO3溶液中可以得到硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯净的乙烯合成的聚乙烯是纯净物 | |
| B. | 聚乙烯可以人工合成,也可以是天然高分子化合物 | |
| C. | 聚乙烯高温分解,生成其单体--乙烯 | |
| D. | 聚乙烯的单体能够使溴的四氯化碳溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com