
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器 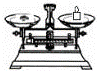

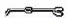
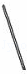

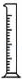
序号 a b c d e f
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度
实验次数 起始温度t1/℃ 终止温度
t2/℃ 温度差平均值
(t2﹣t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 4.0
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H= (取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
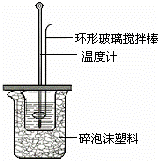
考点: 中和热的测定;有关反应热的计算;热化学方程式;配制一定物质的量浓度的溶液.
专题: 化学反应中的能量变化.
分析: Ⅰ、(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
(2)氢氧化钠要在称量瓶中称量,根据称量固体氢氧化钠所用的仪器来回答;
Ⅱ、(1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)①温度差平均值等于各个温度差的和除以4;
②根据Q=m•c•△T计算;
③a.实验装置保温、隔热效果必须好;
b.量取NaOH溶液的体积时视线要和凹液面相平;
c.允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中;
d.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度.
解答: 解:Ⅰ、(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,故答案为:5.0;
(2)氢氧化钠要在称量瓶或者小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙,故答案为:a b e;
Ⅱ、(1)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钡钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为: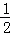 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=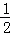 Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol,
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol,
故答案为: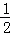 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=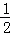 Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;
(2)①温度差平均值= ,但是第2组数据明显有误,所以删掉,
,但是第2组数据明显有误,所以删掉,
温度差平均值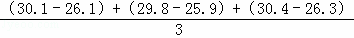 =4.0°C,故答案为:4.0;
=4.0°C,故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放 出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=﹣
出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=﹣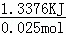 =﹣53.5 kJ/mol,
=﹣53.5 kJ/mol,
故答案为:﹣53.5kJ/mol;
③a.实验装置保温、隔热效果必须好,否则影响实验结果,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于57.3kJ/mol,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c正确;
d.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,故d正确.
故答案为:acd.
点评: 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.


科目:高中化学 来源: 题型:
将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的极,发生的电极反应为 .
(2)该电池工作时(放电)反应的总化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)⇌cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1min后,测得容器内A的浓度为x mol•L﹣1,这时B的浓度为( ﹣)mol•L﹣1,C的浓度为 mol•L﹣1.这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 mol•L﹣1•min﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)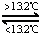 Sn(s,白)△H3=+2.1kJ•mol﹣1,
Sn(s,白)△H3=+2.1kJ•mol﹣1,
下列说法正确的是()
A. △H1>△H2
B. 锡在常温下以灰锡状态存在
C. 灰锡转为白锡的反应是放热反应
D. 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是()
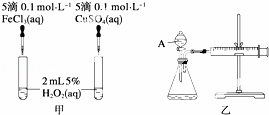
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是()
A. CuCl2(CuO) B. NaCl(HCl) C. NaOH(NaOH) D. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是()
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应符合如图p﹣υ变化曲线的是()

A. H2(g)+I2(g)⇌2HI(g) B. 3NO2(g)+H2O(l)⇌2HNO3(l)+NO(g)
C. 4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) D. CO2(g)+C(s)⇌2CO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是()
A. 溶液中有晶体析出,Na+数目不变
B. 溶液中有气体逸出,Na+数目增加
C. 溶质的质量分数增大
D. 溶液中Na+数目减少,溶质质量分数未变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com