
25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”),其理由是;
(2)a值可否等于5(填“可”或“否”),其理由是,
(3)a的取值范围是.
考点: 酸碱混合时的定性判断及有关ph的计算.
专题: 电离平衡与溶液的pH专题.
分析: 体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,则有:Va•10﹣a=Vb•10b﹣14,结合Va<Vb和a=0.5b进行计算和判断.
解答: 解:(1)若a=3,则b=6,25℃时,溶液显酸性,与题中pH=b的某一元强碱不符,所以a≠3,
故答案为:否;若a=3,则b=6,溶液显酸性,与题意不符,故a≠3;
(2)若a=5,酸溶液中c(H+)a=10﹣5mol•L﹣1,则b=10,碱溶液中c(OH﹣)b=10﹣4mol•L﹣1,恰好中和,则有Va•10﹣a=Vb•10b﹣14,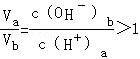 ,不符合题意,故a≠5,
,不符合题意,故a≠5,
故答案为:否;若a=5,c(H+)a=10﹣5mol•L﹣1,则b=10,c(OH﹣)b=10﹣4mol•L﹣1, ,不符合题意,故a≠5;
,不符合题意,故a≠5;
(3)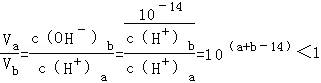 ,
,
所以(a+b﹣14)<0,而a=0.5b,
即3a<14,a<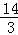 ,
,
又pH=b=2a>7,a>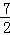 ,
,
所以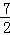 <a<
<a< ,
,
故答案为: <a<
<a< .
.
点评: 本题考查酸碱混合的定性判断和溶液PH的有关计算,题目难度较大,注意酸碱混合时酸碱物质的量的关系以及溶液PH与c(H+)、(OH﹣)的关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列物质在水溶液中的电离方程式错误的是( )
A.NaHCO3===Na++H++CO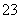
B.NaHSO4===Na++H++SO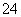
C.MgCl2===Mg2++2Cl-
D.Ba(OH)2===Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性
无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理
后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O 3NH3↑+ 8AlO2-
3NH3↑+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、 Cl-
Cl-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
向10mL pH=12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,溶液呈红色,则这种酸可能是()
A. pH=2的硫酸 B. 0.01 mol•L﹣1的甲酸
C. pH=2的醋酸 D. 0.01 mol•L﹣1的硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某地产孔雀石的主要成分是Cu2(OH)2CO3。
(1)试写出该孔雀石高温分解的化学方程式:__________________________________________。
(2)试以(1)中所得金属氧化物为原料,分别采用湿法冶炼和高温冶炼的方式制取金属铜。供选择的试剂有:①木炭 ②铁屑 ③生石灰 ④稀H2SO4,不得另选其他试剂,写出有关反应的化学方程式。
A.湿法冶炼:________________________________________________________________________;
B.高温冶炼:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素R的原子序数小于18,该元素的原子得到1个电子后形成具有稀有气体元素原子的电子层结构的离子,该元素可形成含氧酸HRO3,下列说法中正确的是( )
①R元素的最高正价是+5价 ②R元素还可形成其他含氧酸 ③R元素原子的最外层电子数为7 ④R元素的原子序数为7
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,一定量的某有机物和过量的金属钠反应产生a L氢气,另取等量的该有机物与足量的小苏打溶液反应,可以收集二氧化碳气体b L,若a=b,则该有机物可能是()
A. HOOC﹣COOH B. HOOC﹣CH2CH2OH
C. HOCH2﹣CH2OH D. CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com