
【题目】取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是( )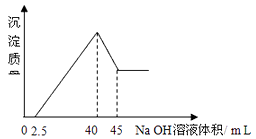
A.1mol/L
B.2mol/L
C.3mol/L
D.4mol/L
【答案】B
【解析】当加入氢氧化钠共40mL时,沉淀量最大,此时溶液溶质为硫酸钠,根据钠元素、硫酸根守恒有2n(H2SO4)=2n(Na2SO4)=n(NaOH)=0.04L×10mol/L=0.4mol,所以n(H2SO4 )=0.2mol,所以原H2SO4 物质的量浓度为0.2mol÷0.1L=2mol/L,答案选B。图像题分析关键还是每一段都要会写出相关反应方程式(或离子方程式)
样品溶于硫酸,SiO2不反应成为沉淀过滤掉,其他物质转变成硫酸铝、硫酸铁、过量硫酸的混合溶液,加入NaOH溶液时,开始阶段(0~2.5)为溶液中剩余硫酸(氢离子)与氢氧化钠反应;第二阶段(2.5~40)为铁离子、氯离子转化为氢氧化物沉淀,至沉淀恰好达最高值时,溶液中仅剩下未参与离子反应的硫酸根离子(来自于硫酸)和钠离子(来自于氢氧化钠);第三阶段(40~45)为氢氧化铝沉淀溶于过量的氢氧化钠溶液,至45时,全部转化为NaAlO2,剩余沉淀为氢氧化铁。
本题所问只需抓住沉淀达最高值时,硫酸根离子(来自于硫酸)和钠离子(来自于氢氧化钠),根据钠元素、硫酸根守恒有2n(H2SO4)=2n(Na2SO4)=n(NaOH),即可解题。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.pH<7的溶液一定是酸性溶液
B.室温时,pH=5的溶液和pH=3的溶液相比,前者c(OH﹣)是后者的100倍
C.室温下,每1×107个水分子中只有一个水分子发生电离
D.HCl溶液中无OH﹣ , NaOH溶液中无H+ , NaCl溶液中既无OH﹣也无H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法正确的是( )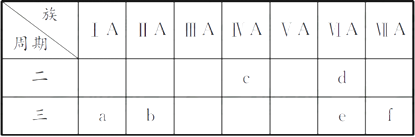
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组的同学分别对四种溶液中所含的离子进行检测,下列所得结果,有错误的是( )
A.K+、Na+、Cl-、NO3-B.OH-、CO32-、Cl-、K+
C.Ba2+、Na+、OH-、NO3-D.Ba2+、NO3-、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。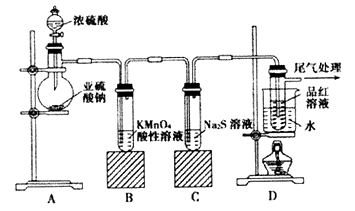
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是。
(2)实验过程中,装置B中产生的现象是 , 这个现象说明SO2具有的性质是。
(3)装置C中Na2S溶液在空气中不易保存,时间长了会变浑浊,原因是(用离子方程式表示)。
(4)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象。
(5)如果把分液漏斗中的浓硫酸换作浓HNO3 , 对此实验是否有影响(填“是”或“否”),请说明你的理由。
(6)工业上用黄铜矿(CuFeS2)冶炼铜,副产品中也有SO2 , 冶炼铜的反应为8CuFeS2 + 21O2 ![]() 8Cu + 4FeO + 2Fe2O3 + 16SO2 , 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。当生成0.8mol铜时,此反应转移的电子数目是。
8Cu + 4FeO + 2Fe2O3 + 16SO2 , 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。当生成0.8mol铜时,此反应转移的电子数目是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。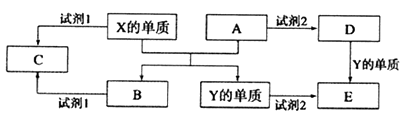
(1)X的单质与A反应的化学方程式是。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是。
②1molC物质与NaOH溶液反应,产生0.5mol沉淀,需消耗NaOH的物质的量为。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4 , 反应中有NO生成,该反应的化学方程式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaCl2溶液加入某无色溶液后,生成白色沉淀,再加入稀HNO3 ,则沉淀不溶解。下列说法正确的是( )
A. 一定存在Ag+ B. 一定存在CO32-
C. 一定存在SO42- D. 以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2 , 且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的化学反应方程式
(2)已知:Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O、2SO2+SeO2+2H2O═Se+2SO ![]() +4H+、SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 .
+4H+、SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 .
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO ![]() →Se+I2+KNO3+H2O②I2+2Na2S2O3═Na2S4O6+2NaI
→Se+I2+KNO3+H2O②I2+2Na2S2O3═Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目
(4)实验中,准确称量SeO2样品0.1500g,消耗0.2000molL﹣1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com