
下列说法正确的是
A.在熔化状态下能导电的化合物为离子化合物
B.根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
C.CO2、SiO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
D.因为Na2O的水溶液能导电,所以Na2O是电解质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持续发展理念相违背的是( )
A.改进汽车尾气净化技术,减少大气污染物的排放
B.开发利用可再生能源,减少化石燃料的使用
C.研发可降解高分子材料,减少“白色污染”
D.过度开发矿物资源,促进地方经济发展
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质及氧化还原反应的叙述,正确的是( )
A.某化合物溶于水导电,则该化合物为电解质
B.NaCl溶液在电流作用下电离成Na+ 和Cl-
C.在氧化还原反应中,非金属单质一定是氧化剂
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中不能用化合反应的方法制得的是
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3 ⑤FeCl2 ⑥ CaSiO3
A.①③ B.②④ C.②③④⑤ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.检验溶液中是否含有SO32-时,用HNO3酸化后再加BaCl2溶液
B.为提高KMnO4溶液的氧化能力,用盐酸酸化KMnO4溶液
C.检验某溶液是否含有Fe3+时,用HNO3酸化后,加KSCN溶液
D.检验溶液中是否含有SO42-时,用HCl酸化后,加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
操作1:将1 L 1.00 mol·L-1的Na2CO3溶液逐滴加入到1 L 1.25 mol·L-1的盐酸中;操作2:将1 L 1.25 mol·L-1的盐酸逐滴加入1 L 1.00 mol·L-1 的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是
A.5∶2 B.2∶5 C.1∶1 D.2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
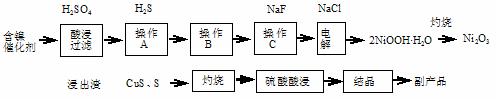
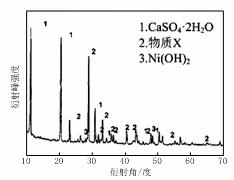
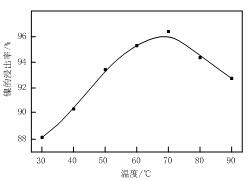
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素, 某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。该实验方案合理吗?若合理,请说明理由;若不合理,请加以改正。__________________________________________。
某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。该实验方案合理吗?若合理,请说明理由;若不合理,请加以改正。__________________________________________。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1(常温时CaF2的溶度积常数为2.7×10-11)。抽滤装置中除了抽气泵、安全瓶外,还需要的主要仪器有_____________________。
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图 ,
(2)E元素在周期表中的位置是 。
(3)D与C按原子个数比为1:1的化合物的用途为 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式)
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与C形成的一种化合物X(化合物X中A、C原子个数比为1:1)反应的离子方程式: 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中的H+移向 (填“正”或“负”)极。
(7)E(s) + O2(g) == EO2(g) △H1 ; E(g) + O2(g) === EO2(g) △H2 ;则△H1 △H2(填“>”或“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.含有离子键和共价键的化合物一定是离子化合物
B.元素原子的最外层电子数等于该元素的最高正化合价
C.目前人们已发现的元素种类数目与原子种类数目相同
D.多电子原子中,在离核较近的区域内运动的电子能量较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com