
| A. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| B. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,Rn元素的相对原子质量是222 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 112号元素属于过渡元素 |
分析 A.质子数相同,中子数不同的同一元素的不同原子互称同位素,中子数=质量数-质子数,核素是指具有一定数目质子和一定数目中子的一种原子;
B.元素的相对原子质量是根据天然同位素原子所占的原子个数百分比和其相对原子质量计算出的平均值,也就是元素周期表上标明的数值;
C.原子符号左上角的数字表示质量数,左下角的数字表示质子数,中子数=质量数-质子数;
D.过渡元素包括副族和ⅥⅡ族,112号元素处于12列.
解答 解:A.${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se的质子数相同都为34,中子数分别为44、46,是两种不同的核素,互为同位素,故A正确;
B.${\;}_{86}^{222}$Rn的相对原子质量为222,但不知该元素的其他同位素的相对原子质量以及原子个数百分比,所以无法计算元素的相对原子质量,故B错误;
C.${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其质子数为92,中子数为235-92=143,两者之差为51,故C正确;
D.第七周期稀有气体原子序数=86+32=118,是第七周期最后一种元素,位于18列,112号元素处于第12列,故112号元素位于第七周期,ⅡB族,故DZ正确;
故选B.
点评 本题考查原子符号的意义、元素的推断,根据原子核外电子排布确定在周期表中的位置,熟练掌握核素的概念以及有关几“同”的概念,注意在原子中,核内质子数=核外电子数=核电荷数,质量数量=质子数+中子数是解答关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

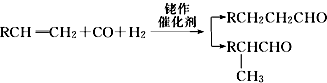
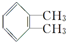 ,名称为邻二甲苯.
,名称为邻二甲苯.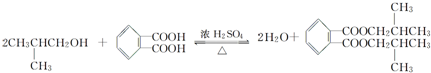 .
.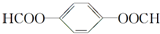 ; 1molX与NaOH溶液共热反应,最多消耗4molNaOH.
; 1molX与NaOH溶液共热反应,最多消耗4molNaOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何晶体中都存在化学键 | |
| B. | 固体SiO2一定是晶体 | |
| C. | 晶体的自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象 | |
| D. | X-射线衍射法是区分晶体和非晶体的唯一方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的气态氢化物稳定性强于其它的非金属气态氢化物 | |
| B. | 原子半径:Z>Y>X | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ23种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法 | B. | 热还原法 | C. | 热分解法 | D. | 铝热法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液中:Rb+、Cs+、CH3COO-、Br- | B. | 饱和溴水中 I-、NO3-、Na+、SO32- | ||
| C. | D+、Cl-、NO3-、SiO32- | D. | Ag+、Fe3+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
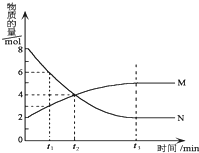 在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为M═2N | |
| B. | 若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率等于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
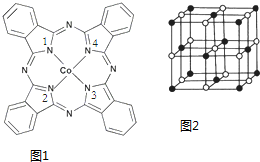
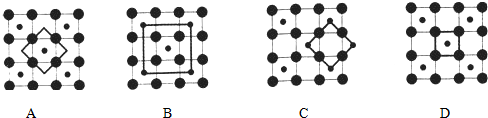
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com