
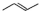 .
. ,该有机物与H2加成时最多能消耗氢气的物质的量3mol,有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
,该有机物与H2加成时最多能消耗氢气的物质的量3mol,有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式 ,将Y加入酸性高锰酸钾溶液中的现象酸性高锰酸钾溶液褪色.
,将Y加入酸性高锰酸钾溶液中的现象酸性高锰酸钾溶液褪色.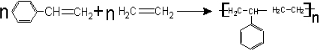
分析 由有机物X的结构可知,X的分子式为C8H8,
(1)有机物结构式中含有三个不饱和键与H2加成时最多能消耗氢气的物质的量为3mol,有机物Y是X的同分异构体,且属于芳香烃,则含苯环,还含C=C;碳碳双键能使酸性高锰酸钾溶液褪色;
(2)Y与乙烯在一定条件下发生等物质的量聚合反应,为加聚反应;
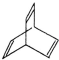
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,其结构对称,含2种位置的H.
解答 解:由有机物X的结构可知,X的分子式为C8H8,
(1)有机物结构式中含有三个不饱和键与H2加成时最多能消耗氢气的物质的量为3mol,有机物Y是X的同分异构体,且属于芳香烃,则含苯环,还含C=C,则Y的结构简式为 ,碳碳双键能使酸性高锰酸钾溶液褪色;故答案为:3mol;
,碳碳双键能使酸性高锰酸钾溶液褪色;故答案为:3mol; ;酸性高锰酸钾溶液褪色;
;酸性高锰酸钾溶液褪色;
(2)Y与乙烯在一定条件下发生等物质的量聚合反应,为加聚反应,该反应为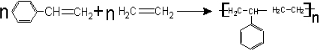 ,
,
故答案为: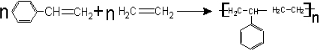 ;
;
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,其结构对称,含-CH2、-CH上方2种位置的H,则Z的一氯代物有2种,故答案为:2.
点评 本题考查有机物的结构和性质,为高考常见题型,题目难度不大,注意把握有机物的官能团的性质,明确加成与加聚反应的差别.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 20℃时,1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA | |
| C. | 1 mol甲基含10 NA个电子 | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多糖是很多个单糖分子按照一定的方式,通过分子内脱水而结合成的 | |
| B. | 多糖在性质上跟单糖、双糖不同,通常不溶于水,没有甜味,没有还原性 | |
| C. | 淀粉和纤维素都是重要的多糖,它们的通式都是(C6H10O5)n,二者互为同分异构体 | |
| D. | 淀粉在稀H2SO4作用下水解最后生成葡萄糖和果糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2中的氢原子数 | B. | 1molOH-中的电子总数 | ||
| C. | 1molHNO3中的氧原子数 | D. | 1molH2SO4溶于水后的离子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将22.4 L HCl溶于水配制1 L溶液,其溶质的物质的量浓度为1.0 mol/L | |
| B. | 1 mol/L的Na2CO3溶液中含有2 mol Na+ | |
| C. | 500 mL 0.5 mol/L的(NH4)2SO4溶液中含有NH4+个数为0.5NA(NA为阿伏加德罗常数) | |
| D. | Na+浓度为0.2 mol/L的Na2SO4溶液中SO42-浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色 | |
| B. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| C. | 紫色石蕊试液滴入SO2水溶液中,先变红后褪色 | |
| D. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com