
 (1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了
(1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了| n |
| 2 |
| 3 |
| 2 |
| n |
| 2 |
| 3n |
| 2 |
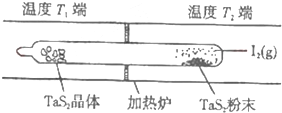
| c(TaI4)c(S2) |
| c2(I2) |
| c(TaI4)c(S2) |
| c2(I2) |
| 0.5x×0.5x |
| (1-x)2 |
| c(TaI4)c(S2) |
| c2(I2) |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l)△H=-Q1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 | ||||
| B、S(s)+O2(g)=SO2(g)△H=-Q1 S(g)+O2(g)=SO2(g)△H=-Q2 | ||||
C、C(s)+O2(g)=CO2(g)△H=-Q1 C(s)+
| ||||
D、H2(g)+Cl2(g)=2HCl(g)△H=-Q1
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W>X>Y>Z |
| B、W>Z>Y>X |
| C、X>Y>Z>W |
| D、Y>X>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
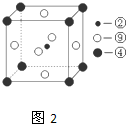 (图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 | B、硝酸钾 |
| C、氯化钡 | D、氯化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“另一种反应物”一定具有氧化性 |
| B、CuH既可做氧化剂也可做还原剂 |
| C、CuH+Cl2═CuCl+HCl↑(燃烧) |
| D、CuH+HCl═CuCl+H2↑(常温) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气与氮气能够缓慢地反应生成氨气,使用合适的催化剂可以提高化学反应速率 |
| B、等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 |
| C、用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率 |
| D、增大反应CO2(g)+H2(g)═CO(g)+H2O(g)的压强,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42? |
| C、加入盐酸无现象,再加氯化钡溶液有白色沉淀生成,原溶液一定有硫酸根离子 |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com