
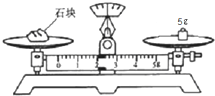
 实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:| n |
| V |


科目:高中化学 来源: 题型:
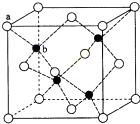 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.查看答案和解析>>
科目:高中化学 来源: 题型:
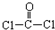 ,每个COCl2分子内含有
,每个COCl2分子内含有
查看答案和解析>>
科目:高中化学 来源: 题型:
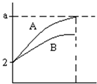 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题:
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
143 60 |
144 60 |
143 60 |
144 60 |
A、
| ||||
B、因各地岩石中
| ||||
C、
| ||||
| D、Nd是镧系元素,镧系元素都互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用太阳能制氢 |
| B、用家用汽车代替公交车 |
| C、利用化石燃料制造燃料电池 |
| D、用节能灯代替白炽灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应I中HCl是氧化剂 |
| B、反应II 中Cl2发生氧化反应 |
| C、还原性:CoCl2>HCl>I2 |
| D、氧化性:Co2O3>Cl2>HIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸 水煤气 水银 干冰 |
| B、蒸馏水 蔗糖溶液 氧化铝 二氧化硫 |
| C、胆矾 盐酸 铁 碳酸钙 |
| D、臭氧 空气 氯化铜 碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com