
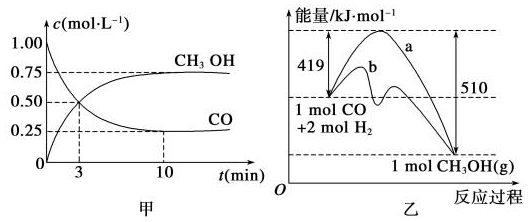
���� ��1��ƽ��ʱv��CO��=$\frac{��1.00-0.25��mol/L}{10min}$=0.075mol/��L��min����v��H2��=2v��CO����
��2������ͼ֪����Ӧ��������������������������˵���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ��1molCO��2mol������ȫ��Ӧ����1mol�״��ų�������Ϊ��510-419��kJ=91kJ��
����ֻ�ܽ��ͷ�Ӧ�����ܵ���Ӱ���ʱ䣻
��3�����������£����д�ʩ����ʹ$\frac{n��C{H}_{3}OH��}{n��CO��}$�������ͨ���������������ʵ������СCO���ʵ������ı�����������������Ũ�ȣ�ʹƽ�������ƶ�ʵ�֣�
��� �⣺��1��ƽ��ʱv��CO��=$\frac{��1.00-0.25��mol/L}{10min}$=0.075mol/��L��min����v��H2��=2v��CO��=2��0.075mol/��L��min��=0.15 mol•L-1•min-1��
�ʴ�Ϊ��0.15 mol•L-1•min-1��
��2������ͼ֪����Ӧ��������������������������˵���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����ԡ�H��0��
1molCO��2mol������ȫ��Ӧ����1mol�״��ų�������Ϊ��510-419��kJ=91kJ����÷�Ӧ�Ȼ�ѧ����ʽΪCO��g��+2H2��g��?CH3OH��g����H=-91 kJ•mol-1��
����ֻ�ܽ��ͷ�Ӧ�����ܵ���Ӱ���ʱ䣬���Դ������ı䷴Ӧ�ȣ�
�ʴ�Ϊ����H��0��CO��g��+2H2��g��?CH3OH��g����H=-91 kJ•mol-1��
���ܣ�
��3��a�������¶�ƽ�������ƶ�����$\frac{n��C{H}_{3}OH��}{n��CO��}$��С����a����
b������1mol He����ƽ�ⲻ�ƶ�����$\frac{n��C{H}_{3}OH��}{n��CO��}$���䣬��b����
c���ٳ���1mol CO��2mol H2����ЧΪ2molCO��4mol H2����4L������ƽ���������СΪԭ����һ�룬ƽ�������ƶ�������$\frac{n��C{H}_{3}OH��}{n��CO��}$����c��ȷ��
d��ʹ�ô�����Ӱ��ƽ���ƶ�����$\frac{n��C{H}_{3}OH��}{n��CO��}$���䣬��d����
��ѡc��
���� ���⿼�黯ѧƽ����㼰��������Ի�ѧƽ��Ӱ���֪ʶ�㣬Ϊ��Ƶ���㣬���ؿ���ѧ������������������ȷ��������Ի�ѧƽ��Ӱ���ƶ�ԭ���ǽⱾ��ؼ���ע�⣨3����cѡ��ĵ�Чƽ�����Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
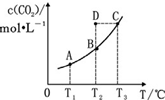 �ں����ܱ������д�������ƽ�⣺CO��g��+H2O��g��?CO2��g��+H2��g����CO2��g����ƽ�����ʵ���Ũ�� c��CO2�����¶� T �Ĺ�ϵ��ͼ��ʾ������˵��������ǣ�������
�ں����ܱ������д�������ƽ�⣺CO��g��+H2O��g��?CO2��g��+H2��g����CO2��g����ƽ�����ʵ���Ũ�� c��CO2�����¶� T �Ĺ�ϵ��ͼ��ʾ������˵��������ǣ�������| A�� | ��Ӧ CO��g��+H2O��g��?CO2��g��+H2��g���ġ�H��0 | |
| B�� | �� T2ʱ������Ӧ����״̬ D������ v ����v �� | |
| C�� | ƽ��״̬ A �� C ��ȣ�ƽ��״̬ A �� c��CO��С | |
| D�� | �� T1��T2ʱ��ƽ�ⳣ���ֱ�Ϊ K1��K2���� K1��K2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��������������ǹ�ҵ����Ҫ�Ļ���ԭ�ϣ�Ҳ��ʵ�����ﳣ�����Լ���
��������������ǹ�ҵ����Ҫ�Ļ���ԭ�ϣ�Ҳ��ʵ�����ﳣ�����Լ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ʳ | ������ͷ |
| ��ʳ | �ռ��顢��Ѽ���������⡢������ |
| ���� | ţ�� |
| ��IJ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.05 mol•L-1 �� H2SO4 ��Һ pH=1 | |
| B�� | 0.001 mol•L-1 �� NaOH ��Һ pH=ll | |
| C�� | 0.005 mol•L-1��H2SO4��Һ��0.01 mol•L-1��NaOH��Һ�������ϣ���Ϻ���ҺpHΪ5����Һ������ | |
| D�� | ��ȫ�к�pH=3��H2SO4��Һ50 mL����ҪPH=11��NaOH��Һ50mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com