
【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:

根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI
【答案】![]() NaFeO2+2H2O=NaOH+ Fe(OH)3↓ NaAlO2、Na2SiO3转化为H2SiO3、Al(OH)3除去 Na2CrO4在酸性条件下可转化为Na2Cr2O7 同温度下K2Cr2O7晶体的溶解度小于Na2Cr2O7,冷却时会结晶析出 加热浓缩、降温结晶 重结晶
NaFeO2+2H2O=NaOH+ Fe(OH)3↓ NaAlO2、Na2SiO3转化为H2SiO3、Al(OH)3除去 Na2CrO4在酸性条件下可转化为Na2Cr2O7 同温度下K2Cr2O7晶体的溶解度小于Na2Cr2O7,冷却时会结晶析出 加热浓缩、降温结晶 重结晶 ![]() 98%
98%
【解析】
由流程可知,焙烧时发生反应铬铁矿的主要成分可表示为FeOCr2O3,还含有SiO2、Al2O3、Fe2O3等杂质,将铬铁矿和碳酸钠、氧气混合焙烧,发生反应4FeOCr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2、Na2CO3+Al2O3=2NaAlO2+CO2↑、Na2CO3+SiO2=Na2SiO3+CO2↑,然后水浸时发生NaFeO2+2H2O=NaOH+Fe(OH)3↓,过滤得到滤渣1和滤液1,K2Cr2O7有强氧化性可知,滤液1中主要是NaAlO2、Na2SiO3、Na2CrO4、NaOH,滤渣1为Fe(OH)3;将滤液1中调节pH使NaAlO2、Na2SiO3反应生成H2SiO3、Al(OH)3,滤渣2是H2SiO3、Al (OH)3,滤液2主要是Na2CrO4,调节pH值酸性,溶质变为Na2Cr2O7,然后加入硫酸钾固体,因为Na2Cr2O7的溶解度大于K2Cr2O7,所以得到K2Cr2O7晶体,采用过滤方法得到K2Cr2O7晶体,以此来解答。
(1)根据题目信息可知Al2O3与Na2CO3反应生成NaAlO2,
故答案为:![]() ;
;
(2)根据分析可知滤渣1为Fe(OH)3,故答案为:NaFeO2+2H2O=NaOH+ Fe(OH)3↓;
(3)滤液1中调节pH可使NaAlO2、Na2SiO3反应生成H2SiO3、Al(OH)3,到达除杂目的,酸性条件下Na2CrO4可转化为Na2Cr2O7;
故答案为:NaAlO2、Na2SiO3转化为H2SiO3、Al(OH)3除去;Na2CrO4在酸性条件下可转化为Na2Cr2O7;
(4)根据表格可知同温度下K2Cr2O7晶体的溶解度小于Na2Cr2O7,Na2Cr2O7;溶液中加入KCl固体可发生复分解反应;K2Cr2O7晶体的溶解度受温度影响大,杂质能溶于水,溶液中得到较多晶体的操作是加热浓缩、降温结晶、过滤、洗涤、干燥;K2Cr2O7晶体进一步纯化操作是重结晶,
故答案为:同温度下K2Cr2O7晶体的溶解度小于Na2Cr2O7,冷却时会结晶析出;加热浓缩、降温结晶;重结晶;
(5)根据题目信息和反应物通过元素守恒可知离子方程式为:![]() ;
;
(6)根据所给的两个方程式可到物质间的数量关系为:K2Cr2O7~3 I2~6 Na2S2O3,n(Na2S2O3)=(0.2000×25×10-3)mol,则样品中n(K2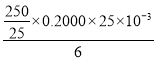 =
=![]() mol,则纯度为
mol,则纯度为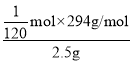 =98%;
=98%;
故答案为:98%。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】布洛芬具有降温和抑制肺部炎症的双重作用。一种制备布洛芬的合成路线如下:
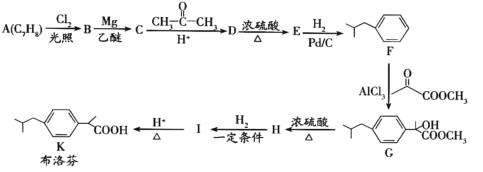
已知:①CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl![]()
![]()
②![]()
![]()
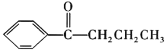 +HCl
+HCl
回答下列问题:
(1)A 的化学名称_____,G→H 的反应类型_____,H 中官能团的名称_________。
(2)分子中所有碳原子可能在同一平面上的 E 的结构简式_____。
(3)I→K 的化学方程式为_____。
(4)写出符合下列条件的 D 的同分异构体的结构简式_____ (不考虑立体异构)。
①能与 FeCl3溶液发生显色反应;
②分子中有一个手性碳原子;
③核磁共振氢谱有七组峰
(5)写出以间二甲苯、CH3COCl 和(CH3)2CHMgCl 为原料制备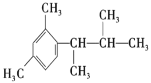 的合成路线________ (无机试剂任选)
的合成路线________ (无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种有机物A的质谱图和红外光谱图如下:
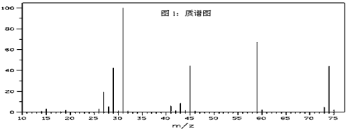
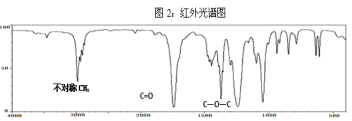
回答下列问题:
(1)结合以上谱图推断:有机物A的相对分子质量为______,分子式为 _____,有机物A的核磁共振氢谱图中有_____种吸收峰,峰面积之比为_______。该有机物与氢氧化钠溶液在加热条件下反应的化学方程式为:_______。
(2)直链烃B的相对分子质量比A小4,含2个甲基,并能使溴的四氯化碳溶液褪色,写出B所有可能的结构简式:______________、__________________。
(3)链烃C是B的同系物,且其对乙烯的相对密度为3,C的核磁共振氢谱显示:C中只含有一种氢原子。则C在一定条件下发生聚合反应的方程式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B. 1mol FeCl3完全水解后可生成NA个氢氧化铁胶粒
C. 常温下,1mol氯气通入足量水中发生反应转移的电子数为NA
D. 100mL 0.1mol/L Na2CO3溶液中含有的阴离子数目大于0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq)△H<0
H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液, ![]() 保持不变
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K≈0.68
CaF2(s)+2H+(aq)K≈0.68
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、M、R、W的原子序数依次增大。X原子是周期表中半径最小的原子,Y原子的最外层电子数是其内层电子数的2倍,Z是地壳中含量最高的元素,M+、R2+与Z2-具有相同的电子层结构,W与M组成的化合物是生活中必备的调味品。根据题给信息按要求回答下列问题。
(1)元素Y在元素周期表中的位置为____________________。
(2)M、W各自的最高价氧化物对应水化物相互反应的离子方程式为_____。
(3)为比较M、R的活泼性,将其单质分别投入______(试剂)中,根据反应的剧烈程度,可证明活泼性强的是_______(填元素符号)。
(4)由Y与X组成的质量比为5∶1的有机物的化学式为__________,写出其所有分子的结构简式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1molL-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵。请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)__。
(2)已知T℃,KW=1×10-13,则t℃___25℃(填“>”、“<”或“=”)。在T℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=_。
(3)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=__(填数据);
②若x+y>14,则a/b=__(填表达式);
③该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为__(填表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种兴奋剂的结构简式如图: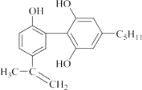 ,下列有关该物质的说法正确的是( )。
,下列有关该物质的说法正确的是( )。
A.1mol 该物质与浓溴水和H2 反应时,最多消耗 Br2 和H2 的物质的量分别为 4 mol、7 mol
B.该分子中所有碳原子可以稳定的共存在一个平面中
C.遇 FeCl3 溶液显紫色,因为该物质与苯酚属于同系物
D.滴入酸性 KMnO4 溶液,观察到紫色褪去,可证明分子中存在双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com