
��12�֣��������е�A��B��C��D��E 5��Ԫ�أ�ԭ��������������A��Dͬ���壻A��B ��ԭ������֮�͵���C��ԭ��������C2?������D+���ӵĺ����������ȣ�Bԭ����D+���ӵĺ��������֮�͵���Eԭ�ӵĺ����������
��ԭ������֮�͵���C��ԭ��������C2?������D+���ӵĺ����������ȣ�Bԭ����D+���ӵĺ��������֮�͵���Eԭ�ӵĺ���������� ��D��E��Ԫ�����γ���������Ϊ1�U1�����ӻ����
��D��E��Ԫ�����γ���������Ϊ1�U1�����ӻ����
��1��EԪ�ص����ӽṹʾ��ͼΪ________��
��2��A��BԪ�ء�A��CԪ�ؾ��ɹ���18���ӵķ��ӣ��仯ѧʽ�ֱ�Ϊ______��_______��
��3��A��CԪ�ؿ����ԭ�Ӹ�����Ϊ1�U1�Ĺ��ۻ������ң���E����ͨ���ҵ�ˮ��Һ�У�����һ��ǿ�ᣬ��������ų�����Ӧ�Ļ�ѧ����ʽΪ ��
��4��A��B��C��D��E�е���������Ԫ�ؿ���ɶ��ֻ����X��Y�����е����֡�X��Y���ǼȺ����Ӽ��ֺ����ۼ������ӻ������X��Y�ֱ�����ˮʱ��X�ܴٽ�ˮ�ĵ��룬��Y������ˮ�ĵ��룬Xˮ��Һ��pH��7��Yˮ��Һ��pH��7��
��0.2mol��L?1��X��Һ��0.1mol��L?1��Y��Һ�������Ϻ���Һ�ʼ��ԡ����жϣ�
��X�Ļ�ѧʽΪ ��Y�Ļ�ѧʽΪ ��
�ڻ����Һ�и��ִ����������ʵ���Ũ���ɴ�С��˳��Ϊ
��
 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
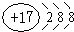
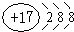
| NH | + 4 |
| NH | + 4 |
| NH | + 4 |
| NH | + 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��B��Aֻ�����BA3������ | B�����Ӱ뾶D+��C2- | C��A��B��C����Ԫ�ؿ����γ����ӻ����� | D��E���������Ӧ��ˮ����һ����ǿ�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com