
| ��ѧ�� | H-H | O=O | H-O |
| ����kJ/mol | 436 | 496 | 463 |
���� ��1������������ȼ������ˮ�Ƿ��ȷ�Ӧ����Ӧ��������������ߣ���H=��Ӧ����ܺ�-��������ܺͣ�
��2��ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ�ã���������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ�У���Ƴ�ԭ��أ�п�ϻ��ã�Ϊ��������������ͭΪ�����������Ϸ�����ԭ��Ӧ����ͭ��������Ӧ����Zn������������Cu��12.9g���Դ������
��3�����ݷ���ʽ����μӷ�Ӧ��B�����ʵ���������v=$\frac{\frac{��n}{V}}{��t}$������v��B�����������ʵ���֮�ȵ��ڻ�ѧ������֮�ȼ���x��ֵ���������ŷ�Ӧ�Ľ��з�Ӧ���Ũ�ȼ��٣���Ӧ���ʼ������Դ˽��
��� �⣺��1����ͼ��֪��A�з�Ӧ����������������������������Ϊ���ȷ�Ӧ��
����2molH2�еĻ�ѧ������2��436kJ����������1molO2�еĻ�ѧ������496kJ������������2��436+496=1368kJ�������γ�4molH-O���ͷ�4��463kJ=1852kJ������2mol H2��������ȼ������2molˮ�ķ�Ӧ�ȡ�H=��Ӧ���м���֮��-�������м���֮��=1368-1852kJ/mol=-484kJ/mol���� H2��������ȼ������1molˮ�ų�������Ϊ242kJ���ʴ�Ϊ��A�� 242��
��2��п�ϻ��ã�Ϊ��������������ͭΪ�����������Ϸ�����ԭ��Ӧ����ͭ��������ӦʽΪCu2++2e-=Cu��ԭ��ع���ʱ�����������ƶ���
1molZnʧ2mol���ӣ�1molͭ���ӵ�2mol���ӣ���ת�Ƶ������ʵ���Ϊxmol����$\frac{x}{2}$mol��65g/mol+$\frac{x}{2}$mol��64g/mol=12.9g��x=0.2mol��
�ʴ�Ϊ��Zn��Cu2++2e-=Cu������ 0.2��
��3����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L���μӷ�Ӧ��A�����ʵ���Ϊ3mol-1.8mol=1.2mol���ɷ���ʽ��֪���μӷ�Ӧ��BΪ1.2mol��$\frac{1}{3}$=0.4mol����1min�ڣ�B��ƽ����Ӧ����Ϊ$\frac{\frac{0.4mol}{2L}}{1min}$=0.2mol/��L��min����
���ɵ�CΪ0.4mol/L��2L=0.8mol����1.2mol��0.8mol=3��x�����x=2��
���ŷ�Ӧ�Ľ��У���Ӧ������С������Ӧ��2min�ﵽƽ�⣬��1min��ƽ������С��ǰ1min��ƽ�����ʣ�ǰ1min��C��Ũ�ȱ仯Ϊ0.4mol/L�����1min��C��Ũ�ȱ仯С��0.4mol/L����ƽ��ʱC��Ũ��С��0.8mol/L��
�ʴ�Ϊ��0.2mol/��L•min���� 2�� С�ڣ�
���� ���⿼���Ϊ�ۺϣ�Ϊ�߿��������ͣ���Ŀ�漰��Ӧ�����ʱ䡢��ѧƽ��ļ��㡢Ӱ�췴Ӧ���ʵ������Լ�ԭ��ص�֪ʶ��������ѧ���ķ��������������Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | ���ܵ�ʵ������ | ���� | |
| A | ij��Һ�м��������ữ���Ȼ�����Һ | �а�ɫ�������� | ��Һ��һ������SO42- |
| B | ��SO2��ͨ�����ᱵ��Һ�� | �а�ɫ�������� | BaSO3���������� |
| C | ͬ��ͬѹ�£���pH��ֽ�ⶨ��ͬŨ�ȵ�̼���ƺ���������Һ������� | ̼������Һ�Լ��ԣ���������Һ������ | ̼���Ʒ�����ˮ�� |
| D | �����KI��Һ��ͨ��Cl2 | ��Һ�ȱ�������ɫ | Cl2�ȱ��������ԡ������ǿ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� | 25�桫550�桫600�桫700�� |
| ��Ҫ�ɷ� | WO3 W2O5 WO2 W |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
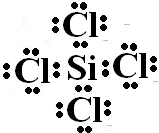 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | A��g��+2B��g��?2C��g������H1��0 | B�� | A��g��+B��g��?C��g��+D��g������H2��0 | ||
| C�� | A��s��+2B��g��?C��g������H3��0 | D�� | A��s��?B��g��+C��g������H4��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
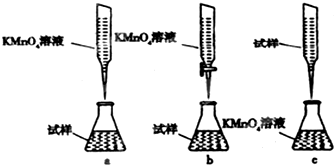
 ��ͼΪʵ������ȡ����������װ�ã�
��ͼΪʵ������ȡ����������װ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com