
|
如下图将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是 | |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
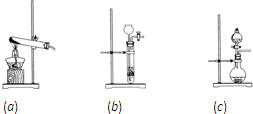
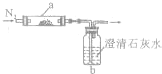 (2011?宝鸡三模)取化学式为XY的黑色粉末状化合物进行如下实验.将XY和足量新制干燥的碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按下图连接仪器进行实验.
(2011?宝鸡三模)取化学式为XY的黑色粉末状化合物进行如下实验.将XY和足量新制干燥的碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按下图连接仪器进行实验.
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| △H1-△H 2 |
| 2 |
| △H1-△H 2 |
| 2 |
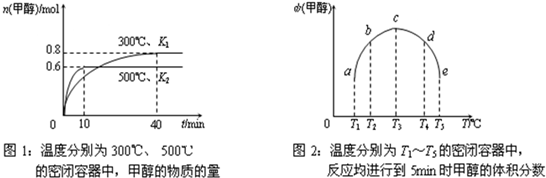
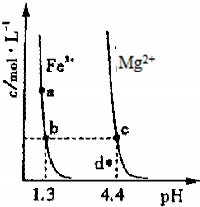
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
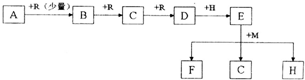
| ||
| ||
| ||
| ||
| 20V |
| 7 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:广东省惠州一中、深圳高级中学2011-2012学年高一下学期期末联考化学试题 题型:022
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________.

(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的?H表示生成1 mol产物的数据).根据上图回答下列问题:

①P和Cl2反应生成PCl3的热化学方程式________;
②PCl5分解成PCl3和Cl2的热化学方程式是________;
(3)科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇(CH3OH)为燃料的燃料电池.已知:
CO(g)+1/2O2(g)=CO2(g); ΔH=-283.0 kJ·mol-1;
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1.
请回答下列问题:
液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为________
(4)已知稀溶液中,H2SO4与1 mol NaOH溶液恰好完全反应时,放出57.3 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式________.
(5)25℃、101 kPa条件下充分燃烧一定量的甲烷气体生成CO2气体和液态水,放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出甲烷燃烧的热化学方程式________.
(6)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
![]()
写出常温常压下氢气与氯气反应的热化学方程式________;
该反应中氢气与氯气的总能量________(填“大于”、“等于”、“小于”)氯化氢的总能量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com