
下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
D.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应
C
【解析】
试题分析:A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,是因为该反应是体系混乱程度增大的反应。错误。B.镀锌铁制品镀层破损后,由于锌活动性比铁强,Zn、Fe及周围的水膜构成原电池,Zn作负极,任然能对Fe起到保护作用;而镀锡铁镀层破坏后,Sn、Fe及水膜也构成原电池,由于Fe的活动性比Sn强,Fe作负极,首先被腐蚀,所以铁制品比受损前更容易生锈。错误。C.由于该反应的正反应是气体体积减小的反应,当其他条件不变时,压缩气体体积使压强增大,各种物质的浓度都增大,所以正反应和逆反应速率都加快。根据平衡移动原理:增大压强,化学平衡向气体体积减小的反应方向移动,即向正反应方向移动,所以H2的平衡转化率增大。正确。D.25℃时水的离子积常数Kw为1.0×10-14,100℃时水的离子积常数Kw为5.5×10-13,温度升高Kw增大,说明升高温度促进水的电离,因此水的电离是吸热过程。错误。
考点:考查反应的自发性、原电池反应与金属腐蚀的关系、弱电解质的电离与温度的关系、压强对可逆反应的速率和化学平衡移动的影响的知识。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
在2A + B = 3C + 4D的反应中,下列表示该反应速率最大的是
A.V(C) =0.5mol / (L·min) B.V(A)=0.8mol / (L·min)
C.V(B)=0.3mol / (L·min) D.V(D)= 1mol / (L·min)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
有A、B、C、D四种金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线连接后浸入稀H2SO4中,电流由D导线C;③A、C相连后同时浸入稀H2SO4中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4中,D极发生氧化反应,试判断四种金属的活动顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应: 3A(g) 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
A.若x=2,则p>0.5a B.若x=3,则p<0.7a
C.若x=4,则p= a D.若x= 5,则p≥a
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+ CO(g)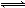 MgO(s)+CO2(g)+SO2(g) ΔH>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项 | X | Y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
(10分)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验 编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后溶 液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1) 从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?
____________________________________________________________。
(2) 乙组混合溶液中c(A-)和c(Na+)的大小关系是_______。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3) 从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4) 分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=_______ mol·L-1。
(5) 某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB-
HB- H++B2-。
H++B2-。
在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c (H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH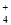 )> c(SO
)> c(SO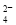 )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO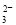 )+c(HCO
)+c(HCO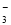 )+c(OH-)
)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO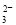 )
)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:
c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:实验题
(12分)硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)。
(2)Fe粉除调pH外,另一个作用是;Fe粉调节溶液的pH为。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为;
所得滤液的主要溶质是(填化学式)。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为。
查看答案和解析>>
科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
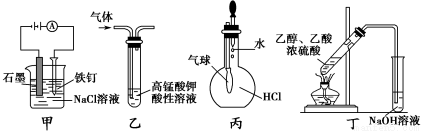
A.装置甲可防止铁钉生锈
B.装置乙可除去CO2中混有的SO2
C.装置丙可验证HCl气体在水中的溶解性
D.装置丁可用于实验室制取乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com