
| A. | Cl:Cl | B. | O::C::O | C. | 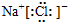 | D. | 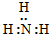 |
分析 A.氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构;
B.二氧化碳分子中每个氧原子和碳原子形成两个共用电子对,每个氧原子含有2个孤电子对;
C.氯化钠为离子化合物,复杂阴离子需要加括号和电荷;
D.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子.
解答 解:A.氯气分子中,2个氯原子通过共用一对电子,形成共价键,电子式为: ,故A错误;
,故A错误;
B.二氧化碳分子中每个氧原子和碳原子形成两个共用电子对,每个氧原子含有2个孤电子对,二氧化碳分子的电子式为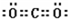 ,故B错误;
,故B错误;
C.氯化钠是离子化合物,由钠离子与氯离子构成,电子式为: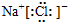 ,故C正确;
,故C正确;
D.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为 ,故D错误;
,故D错误;
故选C.
点评 本题考查电子式的书写,题目难度不大,注意电子式中的电子数是指最外层电子数,而不是指电子总数,阴离子要写出离子的电子分布并加上括号和电荷.


科目:高中化学 来源: 题型:选择题
| A. | 过滤、结晶、焰色反应、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 | |
| B. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,然后涂上稀硼酸溶液 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 检验淀粉是否发生水解,可在溶液中滴加新制氢氧化铜悬浊液,加热至沸腾,若有红色沉淀生成说明已水解,反之则没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成有机高分子化合物称聚合物或高聚物,是因为它们大部分是由小分子通过加聚反应制得的 | |
| B. | 有机高分子化合物的相对分子质量很大,因而其结构复杂 | |
| C. | 对于一块高分子材料,n是一个整数值,因而它的相对分子质量是确定的 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由苯制溴苯;甲烷、氯气在光照条件下得到一氯甲烷、二氯甲烷等 | |
| B. | 由乙烯制1,2-二溴乙烷:由乙烷制一氯乙烷 | |
| C. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 由苯制硝基苯;由苯制环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g 12C的物质的量为2mol | |
| B. | H2的相对分子质量为4 | |
| C. | 1mol水所含的分子数约为3.01×1023 | |
| D. | 56g铁所含的原子数约为6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com