
| 1.28g |
| 64g/mol |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.896L |
| 22.4L/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、聚丙烯的链节:-CH2-CH2-CH2- | ||
B、NH4Cl的电子式: | ||
C、F-结构示意图: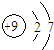 | ||
D、中子数为20的氯原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )| 选项 | 实验现象 | 解释或结论 |
| A | a中溶液褪色 | 还原性:SO32-<I- |
| B | b中加硫酸后产生淡黄色沉淀 | SO32-和S2-在酸性条件下发生反应 |
| C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32-+H2O?HSO3-+OH-,所以滴入酚酞变红; Ba2++SO32-→BaSO3↓(白),使水解平衡左移,红色褪去 |
| D | d中产生白色沉淀 | Na2SO3溶液已被氧化变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )| A、转移0.1mol电子时,a电极产生标准状况下O21.12L |
| B、b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- |
| C、c电极上进行还原反应,B池中的H+可以通过隔膜进入A池 |
| D、d电极上发生的电极反应是:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.2 g不溶物为铁、铜混合物 |
| B、加铁粉之前,溶液中存在的金属阳离子有Cu2+、Fe3+ |
| C、加铁粉之前,溶液中的c(Cu2+):c(Fe2+)=1:1 |
| D、反应结束后溶液中的c(Fe2+)=2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 |
| B、25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小 |
| C、25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力 |
| D、25℃时,饱和Mg(OH)2溶液与0.1mol?L-1NaF溶液等体积混合,能生成MgF2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com