
| A、若Z是有色气体,只压缩容器的体积,平衡不移动,则气体颜色不变 | B、若升高温度,则X的平衡转化率减小,υ(逆)增大,υ(正)减小 | C、若X和Y的平衡转化率相等,则起始时X和Y的物质的量之比为1:4 | D、若平衡时X的转化率为85%,则起始时Y的物质的量浓度为3.4mol?L-1 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:2013届山东省潍坊市高二寒假作业化学(二)试卷 题型:选择题
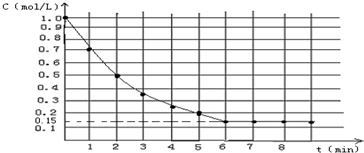
如图表示反应X(g)  4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是
A.第6 后,反应就终止了[来源:]
后,反应就终止了[来源:]
B. 的平衡转化率为85%
的平衡转化率为85%
C.若升高温度, 的平衡转化率将大于85%
的平衡转化率将大于85%
D.若降低温度,v(正)和v(逆)将以同样倍数减少
查看答案和解析>>
科目:高中化学 来源: 题型:
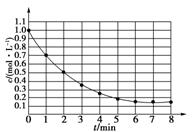
如图表示反应X(g)![]() 4Y(g)+Z(g)(正反应放热),在某温度时X的浓度随时间变化的曲线:
4Y(g)+Z(g)(正反应放热),在某温度时X的浓度随时间变化的曲线:
 下列有关该反应的描述正确的是( )
下列有关该反应的描述正确的是( )
A.第6 min 后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省潍坊市高二寒假作业化学(二)试卷 题型:单选题
如图表示反应X(g) 4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是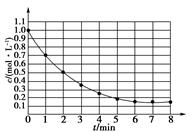
A.第6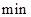 后,反应就终止了 后,反应就终止了 |
B. 的平衡转化率为85% 的平衡转化率为85% |
C.若升高温度, 的平衡转化率将大于85% 的平衡转化率将大于85% |
| D.若降低温度,v(正)和v(逆)将以同样倍数减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com