
| A、SO2→S |
| B、Na2O2→O2 |
| C、Fe2+→Fe3+ |
| D、HCO3-→CO32- |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、-(2.5x-0.5 y) kJ?mol-1 |
| B、-(5x-0.5y) kJ?mol-1 |
| C、-(10x-y)kJ?mol-1 |
| D、-y kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+ Na+ NO3- Cl- |
| B、K+Na+ Cl-AlO2- |
| C、K+ Ba2+ Cl- NO3- |
| D、K+ NH4+SO42- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、开启啤酒后,瓶中马上泛起大量泡沫 |
| B、实验室中常用排饱和食盐水的方法收集氯气 |
| C、对2HI(g)?I2(g)+H2(g),平衡体系增大压强可使颜色变深 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、福尔马林、葡萄糖分别与新制Cu(OH)2共热都有砖红色沉淀生成 |
| B、甲苯和甘油均能与浓HNO3发生反应 |
| C、乙醛和乙烯都能使溴水褪色 |
| D、浓HNO3既能与蛋白质反应,也能与纤维素反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na Cl- S2- |
| B、Cl- CO Na+ |
| C、Fe3+ SO42- NO3- |
| D、Fe2+ O2 H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是银白色的金属 |
| B、氢氧化铊是两性氢氧化物 |
| C、能生成+3价的化合物 |
| D、能置换出盐酸中的氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
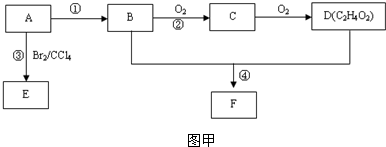
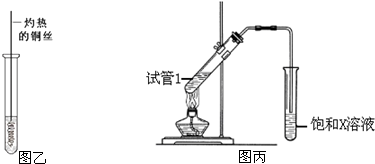
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com