
【题目】(1)1molC2H5OH(1) 完全燃烧生成CO2(g)与H2O(1),放出热量1366.8kJ(写出反应的热方程式)____________
(2)已知H—H键能为436 kJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2 + 3H2 = 2NH3 ΔH=—92.4 kJ/mol,则N≡N键的键能_____
(3)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4kJ/mol
CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=______。
CO2(g)+4H2(g) △H=______。
【答案】C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJmol-1 945.6kJ/mol +175.2kJ/mol
【解析】
(1)注意标注物质聚集状态和对应反应焓变;
(2)焓变ΔH=反应物的总键能-生成物的总键能;
(3)根据盖斯定律计算CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)的△H;
CO2(g)+4H2(g)的△H;
(1)1mol C2H5OH(l) 完全燃烧生成CO2(g)与H2O(l),放出热量1366.8kJ,则反应的热化学方程式是C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJmol-1;
(2) N2 + 3H2 = 2NH3 ΔH= —92.4 kJ/mol,设N≡N键的键能为x,则x+3×436 kJ/mol-6×391kJ/mol= —92.4 kJ/mol,x=945.6kJ/mol;
(3) a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4kJ/mol
CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
根据盖斯定律,a+b得CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)△H=+216.4kJ/mol+(-41.2kJ/mol)= +175.2kJ/mol。
CO2(g)+4H2(g)△H=+216.4kJ/mol+(-41.2kJ/mol)= +175.2kJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法正确的是
A. 乙烯使酸性![]() 溶液和溴的
溶液和溴的![]() 溶液褪色的原理相同
溶液褪色的原理相同
B. 苯与液溴在催化剂作用下生成溴苯发生了加成反应
C. 淀粉、蛋白质等营养物质在人体内最终生成二氧化碳和水排出体外
D. 用![]() 法检验司机是否酒驾利用了乙醇的挥发性和还原性
法检验司机是否酒驾利用了乙醇的挥发性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z与Y形成的化合物的化学式为YZ。下列说法不正确的是()
A.W在元素周期表中的位置是第二周期第VA族
B.同主族中Z的气态氢化物稳定性最强
C.X与Y形成的两种常见的化合物中,阳离子和阴离子的个数比均为2∶1
D.用电子式表示YZ的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中A为银白色固体,B为淡黄色固体,它们有如图所示的转化关系:
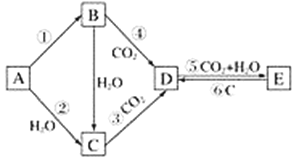
(1)推断各符号所代表的物质的化学式:
A________________,B________________,C________________,D________________,E________________。
(2)分别写出反应②⑤的化学方程式:
②________________________________________________________________________;
⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___,证明Fe3+存在的现象是____,配制含Fe2+的溶液时,常常向溶液中加入少量___,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
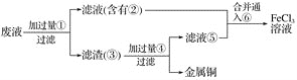
A.请写出上述实验中加入或生成的有关物质的化学式。
①___,②___,③___,④____,⑤____,⑥_____。
B.请写出相关反应的化学方程式。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应X(g)+Y(g)![]() Z(g)+W(g)进行四组实验,实验起始时放入容器内各组分的物质的量见表:
Z(g)+W(g)进行四组实验,实验起始时放入容器内各组分的物质的量见表:
实验 | X | Y | Z | W |
① | amol | amol | 0mol | 0mol |
② | 3amol | amol | 0mol | 0mol |
③ | 0mol | 0mol | amol | amol |
④ | 2amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(Z)的大小顺序是( )
A. ②=④>①=③B. ②>④>①>③
C. ④>②>①=③D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E均可产生白色沉淀,其中A与B反应所产生沉淀不溶于酸,A与E反应所生成的白色沉淀可以溶于C或D;B与D、B与E产生沉淀;E与C、E与D反应均可产生二氧化碳气体;而C与D由于属于同一类物质,混合时无反应现象。
由此,可判定各试剂瓶中所盛试剂为(用化学式表示)
A________;B________;C________;D________;E________。
另外,请写出下面要求的离子方程式:
(1)A与E:
________________________________________________________。
(2)A与B:
_________________________________________________________。
(3)C与E:
__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com