
分析 达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热;当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,根据外界条件对化学平衡的影响解答该题.
解答 解:(1)当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,说明m+n>p,故答案为:吸;>;
(2)当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,所以A的质量分数增大,故答案为:增大;
(3)若保持容器体积不变,加入B,平衡正向移动,A的转化率增大,故答案为:增大;
(4)升高温度,则正、逆反应速率都增大,故答案为:增大;
(5)保持容器体积不变,充入氖气,非反应气体,各物质的浓度不变,所以反应速率不变,故答案为:不变.
点评 本题考查外界条件对平衡移动的影响,注意催化剂不影响平衡移动,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3能电离出CO32-,可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 钠保存在煤油中,是因为煤油不与钠反应,且钠比煤油密度大、煤油可以隔绝空气 | |
| C. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 | |
| D. | 钠长期暴露在空气中的产物是Na2CO3,原因是钠在空气中生成的Na2O会与水和二氧化碳反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数的符号为NA,其近似值为6.02×1023mol-1 | |
| B. | 等物质的量的O2与O3,所含氧原子数相同 | |
| C. | 在0.5molNa2SO4中,含有的Na+数约是6.02×1023 | |
| D. | 化合反应与分解反应可能是氧化还原反应,而复分解反应一定不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
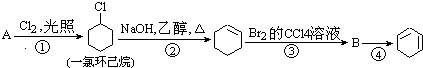
 ,名称是环己烷
,名称是环己烷
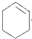 具有的性质叙述正确的是C、D
具有的性质叙述正确的是C、D查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水可鉴别苯、乙醇、苯乙烯(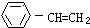 ) ) | |
| B. | 加浓溴水,然后过滤可除去苯中的少量乙烯 | |
| C. | 苯、溴水、铁粉混合制取溴苯 | |
| D. | 可用分液漏斗分离硝基苯和苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com